Сущность метода заключается в измерении оптической плотности анализируемого раствора относительно раствора сравнения, содержащего известное количество определяемого элемента.
Для анализа готовят раствор сравнения с известным количеством анализируемого вещества и при помощи двух кювет, заполненных этим раствором, устанавливают на нуль шкалу оптической плотности. Затем одну из кювет заполняют анализируемым раствором и измеряют оптическую плотность по отношению к раствору сравнения.
Метод применим для повышения точности фотоколориметрических измерений при определении высоких концентраций (от 10до 100 \%).
Концентрацию анализ в-а находя т либо по калибровочному графику либо расчетным путем по формуле:де І7 — фактор пересчета.Сх = Со + Лх¥,
К недостаткам фотоколориметров с одним фотоэлементом относятся непостоянство светового режима (/ 0) и плохая воспроизводимость работы фотоэлемента. Дифференциальные фотоколориметры лишены этих недостатков.
Билет 30
1)Гидролиз соли, образованной слабой кислотой и сильным основанием, например KNO2. Соль в растворе полностью диссоциирует на ионы:
KNO2 → K+ + NO2-
Вода, как уже отмечалось, является слабым электролитом:
Н2О ↔ Н+ + ОН-
Ионы водорода воды взаимодействуют с нитрит-ионами с образованием слабой азотистой кислоты:
KNO2 + Н2О ↔ КОН + НNO2
Или в ионной форме
NO2- + Н2О ↔ НNO2 + ОН-
Гидролизу подвергается анион соли, в молекулы слабого электролита связываются ионы Н+, а в растворе накапливаются свободные ионы ОН-. Реакция раствора щелочная, рН > 7.
Если соль образована многоосновной кислотой, гидролиз идет ступенчато:
Na2CO3 → 2Na+ + CO32-
Н2О ↔ Н+ + ОН-
I ступень Na2CO3 + Н2О ↔ NaHCO3 + NaOH
CO32- + Н2О ↔ HCO3- + ОН-
II ступень NaHCO3 + Н2О ↔ H2CO3 + NaOH
HCO3- + Н2О ↔ H2CO3 + ОН-
Степень гидролиза, как правило, невелика. Причина столь низкой степени гидролиза кроется в том, что один из участников реакции - вода является очень слабым электролитом. Поэтому положение равновесия реакции гидролиза сильно смещено в сторону исходных веществ. Степень гидролиза возрастает с увеличением температуры, поскольку гидролиз - процесс эндотермический.
Гидролитическое равновесие в вод-ых растворах солей следует закону ействующих масс. Поэтому, изменяя онцентрацию одного из продуктов еакции, можно смещать равновесие в у или иную сторону.Гидролитическое равновесие в разбавленных растворах сол характеризуется константой гидролиза. В тех случаях, ког д продукты гидролиза легко растворимы, константу и степень п дролиза нетрудно найти путем несложных вычислений. Гидролитическое равновесие можно легко смещать.
2. Методы окислительно-восстановительного титрования, или редокс-методы, основаны на использовании реакций с переносом электронов — окислительно-восстановительных (ОВ) реакций. Чем выше ОВ потенциал редокс-пары Ох2½Red2, окисленная форма которой играет роль окислителя в данной реакции, тем большее число восстановителейRed1можно оттитровать и определить с помощью данного окислителя Ох2. Поэтому в редоксметрии в качестве титрантов чаще всего применяют окислители, стандартные ОВ потенциалы редокс-пар которых имеют как можно более высокие значения, Редокс-методы — важнейшие фармакопейные методы количественного анализа. Классификация по характеру титранта. оксидиметрия — методы определения восстановителей с применением титранта-окислителя; редуктометрия — методы определения окислителей с применением титранта-восстановителя. по природе реагента, взаимодействующего с определяемым веществом. Броматометрия, бромометрия, дихроматометрия, иодотометрия, иодиметрия, иодометрия, перманганатометрия, иодхлорометрия, нитриометрия, цериметрия. Условия проведения Реакции должны протекать практически до конца.Реакция должна протекать достаточно быстроРеакция должна протекать стехиометрически, побочные процессы должны быть исключены. Конечная точка титрования должна определяться точно и однозначно либо с индикаторами, либо без индикаторов. Виды
Прямое ОВ титрование проводят тогда, когда ОВ реакция удовлетворяет требованиям, перечисленным выше. Обратное ОВ титрование проводят тогда, когда применение прямого титрования нецелесообразно по тем или иным причинам. Заместительное ОВ титрование применяют для определения веществ как вступающих, так и не вступающих в ОВ реакции. Индикатор — вещество, вступающее в специфическое взаимодействие с окислителем или восстановителем (участвующими в ОВ реакции) с образованием окрашенных соединений. Примером может служить свежеприготовленный раствор крахмала, который в присутствии иода окрашивается в синий цвет. Графический метод изображения процесса окисления — восстановления

3) Рефрактометрия (от лат. refractus - преломленный и греч. metreo - измеряю) - метод анализа, основанный на явлении преломления света при прохождении из одной среды в другую. Преломление света, то есть изменение его первоначального направления, обусловлено различной скоростью распределения света в различных средах.
 При этом отношение синуса угла падения луча (α) к синусу угла преломления (β) для двух соприкасающихся сред есть величина постоянная, называемая показателем преломления (n). Показатель преломления также равен отношению скоростей распространения света в этих средах. В лабораторных условиях обычно определяют так называемый относительный показатель преломления вещества по отношению к воздуху помещения, где ведется измерение. Показатель преломления измеряют на приборах рефрактометрах различных систем. Обычно измерение показателя преломления на рефрактометрах Аббе, в основу принципа, действия которого положено явление полного внутреннего отражения при прохождении светом границы раздела двух сред с различными показателями преломления. Обязательным условием определения показателя преломления является соблюдение температурного режима. Обычно определение выполняется при 20±0,30С. При повышении температуры величина показателя преломления уменьшается, при понижении - увеличивается.
При этом отношение синуса угла падения луча (α) к синусу угла преломления (β) для двух соприкасающихся сред есть величина постоянная, называемая показателем преломления (n). Показатель преломления также равен отношению скоростей распространения света в этих средах. В лабораторных условиях обычно определяют так называемый относительный показатель преломления вещества по отношению к воздуху помещения, где ведется измерение. Показатель преломления измеряют на приборах рефрактометрах различных систем. Обычно измерение показателя преломления на рефрактометрах Аббе, в основу принципа, действия которого положено явление полного внутреннего отражения при прохождении светом границы раздела двух сред с различными показателями преломления. Обязательным условием определения показателя преломления является соблюдение температурного режима. Обычно определение выполняется при 20±0,30С. При повышении температуры величина показателя преломления уменьшается, при понижении - увеличивается.
Показатель преломления как константа может быть использован для идентификации тех лекарственных препаратов, которые по своей природе являются жидкостями. Согласно ФС определяют показатель преломления для идентификации галотана (фторотана), никетамида (диэтиламида кислоты никотиновой), токоферола ацетата, а также жирных и эфирных масел (персикового, касторового, эвкалиптового и др.). Рефрактометрия в фармацевтическом анализе широко используется для количественного определения веществ в растворе, особенно в практике внутриаптечного контроля. Примечание. При концентрации вещества менее 3 - 4% не рекомендуется использовать метод рефрактометрии.
При прохождении луча света из среды с меньшим значением n в среду с большим показателем преломления (рис.13а) β < α. Если угол падения α луча С (рис.13б) приближается к 900, то β < 900. При дальнейшем увеличении угла падения (луч D) падающий свет полностью отражается от границы раздела и не попадает в менее плотную среду, происходит полное внутреннее отражение. Справа (при наблюдении против светового потока) от предельного луча D' находится затемненное поле, слева – освещенное поле.
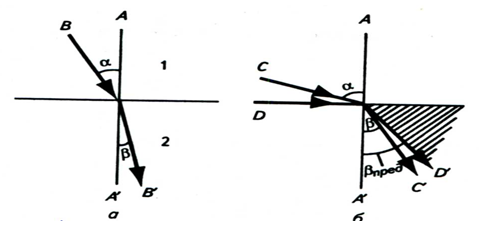
Рис. 13. Преломление луча света при переходе из одной среды в другую:
 а – преломление луча света при прохождении из менее плотной среды 1 в более плотную среду 2; б – преломление луча света при углах падения, приближающихся к 900; предельный луч D - D' (полное внутреннее отражение).
а – преломление луча света при прохождении из менее плотной среды 1 в более плотную среду 2; б – преломление луча света при углах падения, приближающихся к 900; предельный луч D - D' (полное внутреннее отражение).
Билет 31
 1.
1.

При помощи окислительно-восстановительных реакций проводится огромное множество количественного и качественного анализа. Окислительно-восстановительные реакции являются основой почти всех биохимических процессов.
3. Метод кислотно-основного титрования дает возможность титровать растворы солей, например Na2CO3 и NaHCO3. Также можно было бы оттитровать NaH2PO4 до "Na2HPO4 едким натром (с фенолфталеином) и Na2HPO4 до NaH2PO4 соляной кислотой (с метиловым оранжевым). Однако подобное титрование солей, растворы которых имеют вследствие гидролиза щелочную или кислую реакцию, возможно далеко не всегда. Нетрудно видеть, что при титровании раствора соли типа NaAn, образованной сильным основанием (NaOH) и слабой кислотой (HAn), раствором сильной кислоты рН раствора должен изменяться совершенно так же, как он изменяется при титровании слабых оснований.В начале титрования в растворе присутствует соль NaAn, поэтому рН вычисляют по формуле РН == у P^h2O + 4" p/(HAn + 1S 0NaAnВ промежуточные моменты титрования в растворе присутствует свободная слабая кислота HAn:An-+ H+ =f=* HAn вместе с остатком неоттитрованной соли NaAn. Вычисление рН таких смесей проводят по формуле:PH = PKHAn-Ig-^-^NaAnВ точке эквивалентности вся взятая соль^ превращена в свободную кислоту HAn, рН которой может быть вычислен по формуле:рН = у рКнДп - Y1 g СНАпНаконец, при избытке титрующей кислоты рН раствора вычисляется, как обычно, т. е. по общей концентрации HCl в растворе. Для того чтобы наиболее точно зафиксировать точку эквивалентности титрования, необходимо выбрать такой индикатор, который резко меняет свою окраску при значении рН, максимально близком к эквивалентной точке.
3.Потенциометрия основана на измерении разности потенциалов между двумя электродами (индикаторным и электродом сравнения) в отсутствие тока во внешней цепи. В потенциометрии используются два приема: а) прямая потенциометрия – измерение потенциала электрода как функции активности (концентрации) определяемого компонента; в) потенциометрическое титрование – измерение потенциала как функции объема раствора реагента, добавляемого к пробе. В качестве измерительного инструмента используют потенциометр или электронный вольтметр. Виды Воснову положены типы химических реакций: нейтрализации, осаждения, комплексобразования, окисления – восстановления и т. п. Кислотноосновное титрование в качестве индикаторного обычно используют стеклянный электрод, как правило, входящий в комплект серийно выпускаемых промышленностью pH-метров. Комплексонометрическое титрование Потенциометрическое титрование катионов комплексоном III (ЭДТА) можно проводить с использованием в качестве индикаторного электрода соответствующего металла: титрование солей меди с медным электродом, солей цинка с цинковым и т.д. или подходящего ионоселективного электрода. Однако, многие металлические индикаторные электроды необратимы, а число ионоселективных электродов невелико. Титрование по методу осаждения Индикаторными электродами служат металлические или мембранные электроды, чувствительные к определяемому иону или иону-осадителю. Практически по методу осаждения могут быть определены катионы серебра, ртути, цинка, свинца, анионы хлора, брома, иода и некоторые другие. Окислительно-восстановительное титрование Кривые окислительно-восстановительного титрования могут быть построены в координатах или pM - V (титранта) или E - V (титранта), если pM=-lg[M] ([M] - концентрация участника реакции, E - потенциал системы, V (титранта) - объем титранта.Данный метод рекомендуется для установления доброкачественности и количественного анализа некоторых фармакопейных препаратов. Потенциометрический метод также может быть использован при исследовании процессов разрушения лекарственных веществ при хранении.
Билет 32
1) Соли, образованные сильной кислотой и слабым основанием. Например: ZnCl2, Pb(NO3)2, NH4Cl - гидролиз идет по катиону:
NH4Cl + HOH NH4OH + HCl;
NH4++ Cl–+ HOH NH4OH + H++ Cl–;
NH4++ HOH NH4OH + H+.
В результате этой реакции образуются сильная кислота и слабое основание, среда раствора кислая, то есть рН < 7. Для таких солей константа гидролиза (Кг), рН и степень гидролиза (h) вычисляются по следующим формулам:
Кг=  ;
;
рН = 7 − 1/2 рКосн − 1/2 lgСсоли;
h =  .
.
В случае гидролиза соли, образованной многовалентным металлом, гидролиз идет ступенчато, с образованием основных солей. Например:
ZnCl2+ HOH ZnOHCl + HCl (1-я ступень);
Zn2++ 2Cl− + HOH ZnOH++ Cl− + H++ Cl−;
Zn2++ HOH ZnOH++ H+; 
ZnOHCl + HOH Zn(OH)2+ HCl(2-я ступень);
ZnOH++ Cl− + HOH Zn(OH)2+ H++ Cl−;
ZnOH++ HOH Zn(OH)2+ H+.
П римеры использования гидролиза в качественном анализе: Гидролиз солей многоосновных кислот или многокислотных оснований идет ступенчато, главным образом по первой стадии. Поэтому при проведении анализа часто получают кислые или основные соли. С помощью гидролиза отделяют алюминий-ионы от цинк-ионов, хром (Ш)-ионы от алюминий-ионов. При кипячении раствора алюминат натрия не разлагается, а хромит натрия разлагается с образованием осадка Сг(ОН)3. При осаждении катионов второй группы прибавляют NH4OH для подавления гидролиза группового реагента (NH4)2C03. При осаждении катионов III группы сульфидом аммония образуются сульфиды всех катионов, кроме Сг3+ и А13+, которые осаждаются в виде гидроксидов Сг(ОН)3 и А1(ОН)3 Соли, образованные катионами III группы (А13+, Сг3+) и анионами слабых кислот (H2S, Н2СОэ и др.), гидролизуются в такой степени, что практически не существуют в растворе.
2) Комплексонометрия – титриметрический метод анализа, который базируется на использовании реакций ионов-комплексообразователей с комплексонами, которые сопровождаются образованием устойчивых малодиссоциированных растворимых в воде внутрикомплексных солей.
Титрант: 0,05 моль/л раствор трилона Б (вторичный стандартный раствор)
Стандартизация: 1) по Zn + H2SO4 ZnSO4 + H2
2) по MgSO4
3) CaCO3 + HCl Ca2+ + 2Cl- + H2O + CO2
4) Zn + HCl Zn2+ + 2Cl- + H2O
Реакции: Са2+ + H2Y2 → Ca2- + 2H+,
In3+ + H2Y2- → In- + 2H+,
Th4+ + H2Y2- → Th + 2H+.
Индикаторы: металлохромные
 2017-12-16
2017-12-16 1679
1679








