РАЗДЕЛ III. ХИМИЧЕСКИЕ СИСТЕМЫ
ТЕМА 10. Гетерогенные дисперсные системы. Коллоидные
Растворы и полимерные соединения
Общая характеристика дисперсных систем. Получение, физические и химические свойства коллоидных растворов
Все известные в природе и полученные искусственным путем сложные химические системы в зависимости от размеров частиц, их образующих, можно разделить на 4 группы систем:
- Грубодисперсные системы или смеси. Они состоят из двух и более фаз, размеры самой конденсированной фазы - свыше 10-5м. Фактически даже самые маленькие частицы такой системы представляют собой сплошную фазу, видимую невооруженным глазом. К ним относятся, например, смеси сыпучих веществ. В случае, если все компоненты смеси являются твердыми веществами и между ними отсутствует взаимодействие, то система будет кинетически и термодинамически устойчива. К этой же группе относятся и мути (распыленные твердые частицы в жидкости), существующие только при постоянном перемешивании. Такие системы могут существовать достаточно долго, если сохраняются параметры их образования, однако термодинамически неустойчивы и требуют внешнего воздействия на них (например, постоянного перемешивания).
Примечание: кинетическая устойчивость – постоянство системы во времени при заданных условиях; термодинамическая устойчивость – постоянство системы во времени при изменении условий.
- Дисперсные системы или взвеси. Они также состоят из двух и более фаз, но размеры частиц на порядок меньше (10-5÷10-6 м). Одни фазы такой системы являются микрогетерогенными, равномерно распределенными по всему объему другой фазы, представляющей собой сплошную среду, и они видны в микроскопе. К таким системам относятся суспензии, эмульсии, лаки, краски. Устойчивость взвесей несколько выше, хотя и не достаточная для стабилизации во времени.
- Коллоидные или полимерные растворы, имеющие гетерофазное строение в микрообъеме (внутри отдельных молекулярных структур), однако равномерно распределенных по всему объему растворителя. Размеры коллоидных или полимерных частиц лежат в пределах 10-7 ÷ 10-9м. Дисперсная фаза является ультрамикрогетерогенной, увидеть ее можно только в ультрамикроскопе с хорошим разрешением. Системы кинетически и термодинамически устойчивы при отсутствии воздействия извне.
- Истинные растворы - гомогенные по всему объему системы, представляющие собой смесь нейтральных молекул, ионов, с размерами частиц менее 10-9м. Термодинамически устойчивы, в том числе и при оказании внешнего воздействия.
Легко убедиться, что все дисперсные системы состоят из сплошной фазы, называемой дисперсионной средой (ДС), и прерывистой фазы (частиц), называемой дисперсной фазой (ДФ). Свойства систем зависят, в первую очередь, от размеров дисперсной фазы (см. таблицу 1).
Классификация и свойства дисперсных систем Таблица 1.
| Свойства/ Тип системы | Грубо дисперсная система: смесь (т в т); муть (т в ж) | Дисперсная система: взвесь(т в ж); суспензия (т в т); эмульсия (ж в т) | Коллоидная система или полимерный раствор | Истинный раствор |
| 1. Размеры частиц, Ø м | Ø ≥ 10-5 | 10-6≤ Ø <10-5 | 10-9≤Ø<10-7 | Ø < 10-9 |
| 2. Состав системы | Гетерогенная, сплошные фазы | Микрогетерогенная, дисперсная фаза раздроблена | Ультрамикрогетерогенная, фазы не выделяются | Гомогенная система |
| 3. Устойчи вость | Кинетически (кин.) и термодинамически (т/д) неустойчивая | Кин.-устойчивая, т/д - нет | Кин. И т/д устойчивая при определенных внешних условиях | Кин. и т/д устойчивая при любых условиях и их изменении |
| 4.Оптические свойства | Светопоглощение): Ø >> λсв. | Светоотражение: Ø > λсв. | Светопреломление («конус» Тиндаля): Ø < λсв. | Светопропускание: Ø << λсв. |
| 5.Кинетические свойства | Вертикальная подвижность дисперсной фазы ДФ в дисперсионной среде ДС под действием сил гравитации: ØДФ>> ØДС | Флуктуации ДФ под действием молекул ДС: ØДФ> ØДС | Броуновское движение частиц ДФ в ДС: ØДФ≈ ØДС | Равномерное и свободное распределение ДФ и ДС, нет различия между ними |
| 6.Электрические свойства | Не проводит электрический ток | Не проводит электрический ток | Электропроводимость слабая (перемещение частиц ДФ под действием тока) | Хорошая электропроводность в растворах электролитов и отсутствие электропроводности в растворах неэлектролитов |
На практике используется и другой принцип классификации дисперсных систем – по агрегатному состоянию дисперсионной среды и дисперсной фазы. Этот принцип классификации иллюстрирует таблица 2.
Типы дисперсных систем Таблица 2.
| Тип дисперсной системы | Фазовое состояние дисперсионной среды ДС | Фазовое состояние дисперсной фазы ДФ | Примеры систем |
| Аэрозоль | Газ (г) | Жидкость (ж) | Туман, облака |
| Аэрозоль | Газ (г) | Твердое вещество (т) | Дым, пыль |
| Пена | Жидкость (Ж) | Газ (г) | Пена, взбитые сливки |
| Эмульсия | Жидкость (ж) | Жидкость (ж) | Молоко, сметана |
| Золь | Жидкость (ж) | Твердое в-во (т) | Краски, лаки |
| Твердая эмульсия, гель. | Твердое вещество (т) Твердое вещество (т) | Жидкость (ж) Жидкость (ж) | Масло Желе, студень. |
Коллоидные системы занимают особое место среди дисперсных систем в силу ряда особенностей их свойств и чрезвычайно широкой сферы применения. Как уже было отмечено выше, природным растворителем является вода и большинство водных систем по своей структуре напоминают не истинные, а коллоидные растворы. К ним относятся почвенные растворы, гумус, клеточный сок растений, кровь и лимфа животных и человека, животное молоко и жидкие природные масла. Представляет не только научный, но и практический интерес изучение механизмов образования таких систем, исследование условий их термодинамической устойчивости, поиск новых составов и направлений использования.
Размеры частиц дисперсной фазы в коллоидной системе чрезвычайно малы (10-7 ÷ 10-9м), поэтому она обладает очень развитой поверхностью (расчеты показывают, что при размерах частиц ø10нм в 1см3 объема системы общая площадь поверхности раздела фаз составит 1010м2). При такой огромной площади поверхности величина поверхностной энергии также будет высока. Этот фактор чрезвычайно влияет на сорбционные процессы в коллоидной системе. Установлено, что частицы дисперсной фазы обладают электростатическим зарядом, обеспечивающим их устойчивость. Причины появления заряда на поверхности коллоидной частицы мы объясним немного позже.
Методы получения коллоидных систем основаны на двух принципах:
а) диспергирование или измельчение твердой фазы компонента до размеров коллоидных частиц (так получают коллоидные растворы металлов и оксидов металлов). Для измельчения применяют различные приспособления: диспергаторы, коллоидные мельницы, электрическую дугу;
б) конденсация или укрупнение зародышей из нескольких атомов, молекул, ионов до размеров коллоидных частиц (так получают коллоидные растворы ограниченно растворимых веществ – гидроксидов металлов, солей). Для укрупнения частиц применяют процессы химического осаждения соединений из истинных растворов с помощью реакций обмена, гидролиза, нейтрализации, окислительно-восстановительных процессов, а также физико-химические методы замены растворителя.
Для повышения устойчивости коллоидов в систему вводят растворы стабилизаторов (к ним относятся поверхностно-активные вещества, потенциалопределяющие ионы).
Коллоидные системы обладают специфическими свойствами, выгодно отличающими их от свойств истинных растворов.
Оптические свойства: в проходящем свете коллоидный раствор четко демонстрирует направление светового потока (см. рис.65). Этот эффект известен под названием «Конус Тиндаля» по фамилии ученого, открывшего и описавшего это явление.
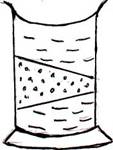 |
Рис. 65. Явление преломления светового луча в частицах коллоида
(эффект Тиндаля)
Эффект объясняется рассеянием света частицами дисперсной фазы. Но размеры частиц все же меньше длины световой волны видимой части спектра, поэтому свет не отражается от поверхности твердой фазы, а лишь отклоняется ею. Вот почему мы видим направление светового потока, но не видим самих частиц коллоида. Наоборот, в дисперсных системах размеры частиц больше длины световой волны, поэтому свет полностью отражается от твердой поверхности, и наблюдатель устанавливает величину и форму поверхности твердой фазы без оптического увеличения. В истинном растворе размеры частиц несоизмеримо малы по сравнению с длиной световой волны и не препятствуют свободному прохождению света. На свойстве коллоидов к светорассеянию основаны методы распознавания коллоидных систем.
Эффект Тиндаля можно наблюдать в темноте при прохождении луча света через запыленное или накуренное помещение (в этом случае загрязненный воздух представляет из себя коллоидную систему твердой дисперсной фазы в газовой дисперсионной среде).
Кинетические свойства: заключаются в хаотичном перемещении частиц дисперсной фазы в дисперсионной среде, испытывающих при этом беспорядочные удары со стороны молекул среды. Если частица велика (как в грубодисперсной системе), то она одновременно испытывает множество ударов со всех сторон от маленьких молекул дисперсионной среды. В результате эти удары взаимно уравновешиваются и частицы практически остаются в состоянии колебания в определенных точках пространства (т.н. флуктуации). Если же частица мала (1-10нм), то сильный удар с одной стороны и удар с другой не совпадают по амплитуде с колебаниями самой молекулы. В результате направление движения частицы непрерывно и беспорядочно изменяется. Описанное кинетическое свойство впервые наблюдал шотландский ботаник Броун, поэтому такой вид теплового движения коллоидных частиц получил название Броуновского движения.
Эффект Броуновского движения в истинных растворах также отсутствует в силу незначительных размеров частиц и гомогенности системы.
Электрические свойства коллоидных систем обнаружил в 1909г. профессор Московского университета Ф.Ф.Рейсс, воздействуя постоянным электрическим током на дисперсную фазу (глину) в дисперсионной среде (воде). Он установил эффект перемещения частиц дисперсной фазы и молекул дисперсионной среды к разным полюсам электродов. Следовательно, в коллоидной системе частицы дисперсионной среды и дисперсной фазы заряжены, причем, противоположными зарядами.
 |
Рис. 66. Схема устройства для демонстрации электрофореза.
Движение частиц дисперсной фазы к одному из электродов при пропускании через коллоид постоянного электрического тока назвали электрофорезом. Обратное явление – движение под действием электрического тока молекул дисперсионной среды при искусственно создаваемом препятствии перемещению дисперсной фазы назвали электроосмосом. На рис. 66 и 67 представлены схемы устройств для демонстрации явлений электрофореза и электроосмоса.
Свойства электрофореза и электроосмоса коллоидных растворов нашли широкое применение в медицинской практике (для обеспечения проникновения лекарственных препаратов через полупроницаемую мембрану – кожу человека) и в фармацевтической промышленности для очистки лекарственных средств.
 |
Рис.67. Схема устройства для демонстрации электроосмоса.
 |
Исследуя структуру заряженной поверхности коллоидной частицы, Рейсс установил, что на границе раздела фаз дисперсная фаза - дисперсионная среда (обозначается эта граница раздела как ДФ|ДС) возникает двойной электрический слой (ДЭС), состоящий из тонкого слоя адсорбционной части и протяженного в пространстве диффузного слоя (см. рис.68,а). Разность потенциалов в ДЭС называют электротермодинамическим потенциалом гетерофазной поверхности (он обозначается греческой буквой фи – φ). Часть скачка потенциала, обусловленная размерами диффузного слоя, непосредственно примыкающего к адсорбционному, называют электрокинетическим или дзетта-потенциалом (обозначается как ξ – потенциал). Изменение потенциала по мере удаления от поверхности твердой фазы представлено на рис.68,б.
Рис. 68. Структура двойного электрического слоя на границе раздела
фаз ДФ|ДС: а) схема распределения зарядов;
б) изменение потенциала внутри ДЭС.
Величина ξ – потенциала зависит от концентрации дисперсной фазы, величины заряда его поверхности (или строения потенциалопределяющих ионов), концентрации и строения противоионов, формирующих диффузный слой, и температуры.
 2017-12-16
2017-12-16 4637
4637