Рассмотрим простейший случай, когда кинетическое уравнение имеет вид (2.1.7). В этом случае с учетом (2.1.2) можно записать:

После разделения переменных и интегрирования при граничных условиях времени от 0 до t и концентраций – от С0 до С получаем:

или
 (2.1.15)
(2.1.15)
Подставляя C = C0 /2, найдем время полупревращения:
 (2.1.16)
(2.1.16)
Таким образом, время полупревращения для реакций второго порядка обратно пропорционально исходной концентрации реагирующего вещества С0.
Для реакций второго порядка, характерна линейная зависимость обратной концентрации от времени (рис. 2.1.4) и константа скорости равна тангенсу угла наклона прямой к оси времени: 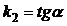
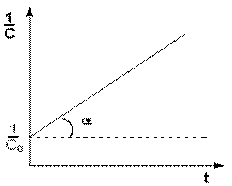
Рис. 2.1.4. Зависимость обратной концентрации от времени для реакций второго порядка
Порядок химической реакции есть формальное понятие; физический смысл порядка реакции для элементарных (одностадийных) реакций заключается в следующем: порядок реакции равен числу одновременно изменяющихся концентраций. В случае элементарных реакций, как уже отмечалось ранее, порядок реакции равен сумме коэффициентов в стехиометрическом уравнении реакции; однако в общем случае порядок реакции определяется только из экспериментальных данных и зависит от условий проведения реакции.
Рассмотрим в качестве примера элементарную реакцию гидролиза этилового эфира уксусной кислоты (этилацетата):
СН3СООС2Н5 + Н2О ––> СН3СООН + С2Н5ОН
Если проводить эту реакцию при близких концентрациях этилацетата и воды, то общий порядок реакции равен двум и кинетическое уравнение имеет следующий вид:

При проведении этой же реакции в условиях большого избытка одного из реагентов (воды или этилацетата) концентрация вещества, находящегося в избытке, практически не изменяется и может быть включена в константу скорости; кинетическое уравнение для двух возможных случаев принимает следующий вид:
1) Избыток воды:
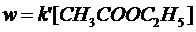
здесь

2) Избыток этилацетата:


В этих случаях мы имеем дело с реакцией псевдопервого порядка. Проведение реакции при большом избытке одного из исходных веществ используется для определения частных порядков реакции.
 2017-12-16
2017-12-16 395
395








