Протеинкиназа, активность которой регулируется цАМФ, называется протеинкиназой А (ПКА). ПКА представляет собой тетрамер, состоящий из двух регуляторных (R) и двух каталитических (C) субъединиц, образующих четвертичную структуру типа R2C2. Регуляторный димер является мишенью для цАМФ. Каталитические субъединицы у разных цАМФ-протеинкиназ не идентичны. Они различаются прежде всего специфичностью в отношении белковых субстратов. При связывании цАМФ происходит диссоциация холофермента на регуляторный димер и две каталитические субъединицы. Для освобождения одной каталитической субъединицы необходимо связывание 2-х молекул цАМФ с одной регуляторной субъединицей. Холофермент не обладает каталитической активностью. После отщепления от регуляторной субъединицы, оказывающей ингибирующее влияние, каталитическая субъединица приобретает протеинкиназную активность. Она фосфорилирует белки по серину и треонину. Ковалентное фосфорилирование этих остатков регулирует активность этих белков.
Концентрация ПКА в клетках млекопитающих достаточно высока, чтобы связать практически весь цАМФ и сделать его недоступным для гидролиза фосфодиэстеразой. Однако при диссоциации комплекса связывание цАМФ с регуляторной субъединицей ослабевает, цАМФ диссоциирует и становится доступной для фосфодиэстеразы, активность которой к тому же усиливается фосфорилированием ПКА. Фосфодиэстераза может ингибироваться кофеином, что ведет к внутриклеточному накоплению цАМФ. Возврат системы в исходное, не активированное состояние происходит после дефосфорилирования белков соответствующими фосфатазами.
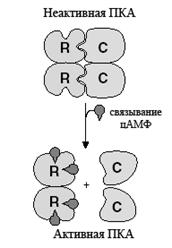
Рис. 4.3.8. Переход протеинкиназы А из неактивного состояния в активное, посредством связывания цАМФ
 2017-12-16
2017-12-16 2510
2510








