Для многоэлектронных атомов, даже атома гелия, точное решение уравнения Шредингера превращается в непосильную задачу. Приходиться прибегать к ряду допущений, позволяющих составить уравнение в привычном виде и получить приближенные решения.
Одноэлектронное приближение – один из методов нахождения волновых функций и энергетических состояний электронов в многоэлектронных атомах. В основе этого приближения лежит допущение, что поведение каждого электрона можно рассматривать независимо от других и описывать его одноэлектронным уравнением Шредингера. Потенциальная энергия, действующая на конкретный электрон со стороны ядра, уменьшается за счет коллективного поля остальных электронов (рис.18). 
Рисунок 18. Электрон в многоэлектронном атоме в рамках одноэлектронного приближения
Уменьшение воздействия на электрон положительного заряда ядра из-за наличия других электронов может быть количественно учтено введением понятия эффективный заряд ядра Z э и постоянной экранированияs n,l:
Z э = Z - s n,l
Допущение об экранировании – это формальный способ учета взаимного отталкивания электронов. Экранирование возрастает с увеличением числа электронных слоев, окружающих ядро, т.е. увеличением главного квантового числа. Следовательно, понижение энергии орбитали с ростом главного квантового числа уменьшается.
Степень экранирования электрона зависит от распределения электронной плотности его орбитали. На рисунке 19 отражено радиальное распределение квадрата волновой функции для электронов третьего энергетического уровня (n =3) и разной формой орбиталей (l =s,p,d).
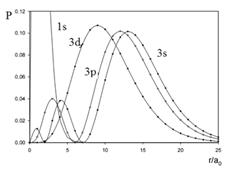
Рисунок 19. Радиальное распределение квадрата волновой функции для электронов третьего энергетического уровня (n =3) и разной формой орбиталей (l =s, p, d).
Видно, что 3 s -орбиталь в значительной степени перекрывается с распределением внутренних электронов (на рисунке – 1 s). Это означает, что вероятность обнаружить электрон 3 s -орбитали вблизи ядра, области с незначительным экранированием, довольно велика. Доля 3 p -орбитали в этой области меньше, а 3 d -орбитали – еще меньше. Следовательно, с возрастанием орбитального квантового числа
- увеличивается эффект экранирования;
- уменьшается энергия взаимодействия электрона с ядром;
- возрастает энергия орбитали.
На рисунке 20а изображены уровни энергии электронных орбиталей для водорода и водородоподобных атомов. Она меняется только с главным квантовым числом, и не зависит от формы орбитали. На графике 20б видно, что в многоэлектронном атоме происходит понижение энергии электронных уровней и снятие вырождения. Из-за разницы во влиянии эффекта экранирования на s,p,d -орбитали, уровень 4 s оказывается энергетически выгоднее, чем 3 d и т.п.

Рисунок 20.Энергия электронный орбиталей
а) водородоподобных атомов
б) многоэлектронных атомов
Состояние атома, при котором суммарная энергия электронов является минимальной, называется основным или невозбужденным. Состояния с более высокими значениями энергии называются возбужденными. Распределение электронов по орбиталям в основном состоянии происходит в соответствии с тремя принципами:
- Принцип минимума энергии электронов
- Принцип (запрет) Паули
- Правило Хунда.
Принцип минимума энергии определяет порядок заселения электронных орбиталей различной энергии. Согласно этому принципу, электроны занимают в первую очередь орбитали, имеющие наименьшую энергию. Энергия подуровней возрастает в ряду: 1 s < 2 s < 2 p < 3 s < 3 p < 4 s < 3 d < 4 p < 5 s < 4 d < 5 p < 6 s < 4 f ≈ 5 d < 6 p < 7 s < 5 f ≈ 6 d.
Принцип Паули гласит, что в атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел. Два электрона могут иметь одинаковый набор n, l, ml, но тогда их спиновое квантовое число должно различаться. Т.е. на каждой орбитали может находиться или один электрон, или два электрона с противоположным спином.
Правило Хунда требует, чтобы суммарный спин (и сумма спиновых квантовых чисел) электронов был максимален. Поэтому, орбитали энергетического подуровня сначала заселяют одиночные электроны с параллельными (одинаковыми по знаку) спинами. После того, как одиночные электроны займут все орбитали, возможно заселение орбиталей вторым электроном с противоположным спином.
 2018-01-08
2018-01-08 2027
2027
