Энергия электрона определяется только главным квантовым числом – n, которое может принимать целочисленные значения от нуля до бесконечности. Главное квантовое число совпадает с номером энергетического уровня.
Каждому собственному значению энергии соответствует одна или несколько собственных функций различающихся значениями квантовых чисел l, ml.
Состояния с одинаковой энергией называются вырожденными, а число состояний с одинаковым значением энергии называется кратностью вырождения энергетического уровня.
Орбитальное квантовое числоl определяет значение орбитального момента количества движения электрона L.
 |
Возможные значения для орбитального числа находятся в интервале от нуля до (n –1). Квантовое число l характеризует энергетический подуровень. Традиционно подуровень со значением l = 0 обозначается буквой s, l = 1 – буквой p, l = 2 – буквой d, l = 3 – буквой f и т.д..
Орбитальное квантовое число определяет форму электронной орбитали.
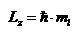 Магнитное квантовое число ml, определяет проекцию момента импульса во внешнем силовом поле на выбранное направление в пространстве, обычно ось z:
Магнитное квантовое число ml, определяет проекцию момента импульса во внешнем силовом поле на выбранное направление в пространстве, обычно ось z:
При заданном l магнитное квантовое число может принимать значения: -l, (-l+ 1 ),..., 0 ,...,(l– 1 ), l. табл.1.
Таблица 1. Форма электронных орбиталей в зависимости от квантовых чисел l и ml
| ml= -3 | ml= -2 | ml= -1 | ml= 0 | ml= +1 | ml= +2 | ml= +3 | |
| l= 0 |  | ||||||
| l= 1 |  |  |  | ||||
| l= 2 |  | 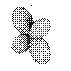 | 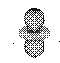 |  |  | ||
| l= 3 |  |  | 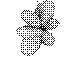 |  | 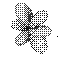 |  |  |
Энергетические уровни атома водорода по Шредингеру совпадают с уровнями, полученными Нильсом Бором и коррелируют со спектрами испускания и поглощения. Однако, эксперименты отчетливо показывают расщепление линий атомных спектров в магнитном поле.
Для объяснения этих экспериментов в 1925 году физики Сэмюэл Гаудсмит и Джордж Уленбек ввели понятие спина. Они опубликовали смелую гипотезу о том, что электрон является носителем собственных механического и магнитного моментов, не связанных с движением электрона в пространстве. Первоначально многие физики предполагали, что спин обусловлен вращением электрона вокруг своей оси. Однако такая модель вращающегося «волчка» или заряженного шарика оказалась несостоятельной, так как расчет показал, что магнитный момент, равный по величине собственному магнитному моменту электрона можно индуцировать только при скорости вращения существенно превышающей скорость света. Кроме того, согласно современным представлениям, электрон – точечная частица, следовательно, у нее не может быть оси вращения.
Спин – это собственный момент количества движения элементарных частиц, имеющий квантовую природу, не связанный с перемещением частицы как целого. Спин электрона это внутреннее свойство электрона, такая же количественная характеристика квантовых частиц, как масса и заряд. Если заряд указывает на степень взаимодействия частицы с электромагнитным полем, то спин – с магнитным.
Спиновое квантовое число ms характеризует проекцию спинового момента электрона на ось z и имеет два значения ±1/2.
Квантовое число ms не вытекает из уравнения Шредингера. Теоретический вывод спинового числа следует из волнового уравнения Поля Дирака, учитывающего принципы специальной теории относительности.
Уравнение Шредингера можно решить для систем похожих на атом водорода – водородоподобных атомов. Такие атомы содержат ядро и только один электрон. Набор собственных энергий будет отличаться лишь на множитель равный заряду ядра.
 2018-01-08
2018-01-08 7415
7415
