Электронная конфигурация атома – это формула описывающая расположение электронов по различным электронным оболочкам атома химического элемента. Количество электронов в нейтральном атоме числено равно заряду ядра, а, следовательно, порядковому номеру в периодической таблице.
По мере того, как у атома увеличивается число электронов, они заполняют различные подуровни электронной оболочки атома. Каждый подуровень электронной оболочки, будучи заполненным, содержит четное число электронов:
- s-подуровень содержит единственную орбиталь, которая, согласно Паули, может содержать максимум два электрона.
- p-подуровень содержит три орбитали, и поэтому может содержать максимум 6 электронов.
- d-подуровень содержит 5 орбиталей, поэтому в нем может быть до 10 электронов.
- f-подуровень содержит 7 орбиталей, поэтому в нем может быть до 14 электронов.
Электронные орбитали нумеруются в порядке возрастания главного квантового числа (номера уровня), которое совпадает с номером периода. Заполняются орбитали по возрастанию энергии (принцип минимума энергии): 1 s, 2 s, 2 p, 3 s, 3 p, 4 s, 3 d, 4 p, 5 s, 4 d, 5 p, 6 s, 4 f, 5 d, 6 p, 7 s, 5 f, 6 d, 7 p. Если знать порядок заполнения орбиталей и понимать, что у каждого последующего атома элемента в периодической таблице на один электрон больше, чем у предыдущего, легко заполнять их, в соответствии с количеством электронов в атоме.
В химических превращениях участвуют только электроны внешнего уровня атома – валентные электроны. Элементы, завершающие периоды периодической таблицы, инертные газы, имеющие полностью заполненные электронные орбитали, химически очень устойчивы. Чтобы записать краткую электронную конфигурацию атома А, достаточно записать в квадратных скобках химический символ ближайшего инертного газа с меньшим по сравнению с атомом А числом электронов, а затем добавить конфигурацию последующих орбитальных подуровней.
Графическое изображение электронной конфигурации демонстрирует расположение электронов по квантовым ячейкам. Квантовые ячейки следует располагать относительно друг друга, учитывая энергию орбиталей. Ячейки энергетически вырожденных орбиталей располагаются на одном уровне, более энергетически выгодные – ниже, менее выгодные – выше. В таблице изображена электронная конфигурация атома мышьяка. Заполненные, как и наполовину заполненные d- подуровни, имеют более низкую энергию орбиталей, чем s- подуровни, поэтому нарисованы ниже. В таблице 2 представлена конфигурация для атома мышьяка.
Таблица 2. Электронная конфигурация атома мышьяка As
| Элемент | Электронная конфигурация | Графическое изображение |
| As Заряд ядра (порядковый номер) z = 33; Общее число электронов – 33; Главное квантовое число внешнего электронного уровня (номер периода) n = 4; Число электронов на внешнем электронном уровне (номер группы в длиннопериодном варианте) – 15. | 1 s 22 s 22 p 63 s 23 p 63 d 104 s 24 p 3 или [Ar]3 d 104 s 24 p 3 | 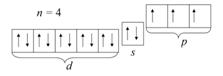 |
Существуют исключения электронных конфигураций атомов в основным энергетическим состоянием, например: Cr ([Ar]3 d 54 s 1); Cu ([Ar]3 d 104 s 1); Mo ([Kr]4 d 5 5 s 1); Ag ([Kr]4 d 105 s 1); Au ([Xe]4 f 145 d 106 s 1.
Химическая связь
Свойства вещества определяются его химическим составом, порядком соединения атомов в молекулы и кристаллические решетки и их взаимным влиянием. Электронное строение каждого атома предопределяет механизм образования химических связей, ее тип и характеристики.
 2018-01-08
2018-01-08 3207
3207
