Строение атома – заряд ядра, число электронов и взаимное расположение орбиталей – определяют химические физико-химические свойства атомов элементов.
Квантовая механика не позволяет считать атом шариком определенного радиуса. Вероятность обнаружения электронов конкретного атома не обращается в ноль даже на бесконечно большом расстоянии. Экспериментально можно определить расстояние между соседними атомами и считать его суммой их атомных радиусов. Радиус атома Ra полагают равным половине наименьшего межъядерного расстояния между одинаковыми атомами. В общем случае атомным радиусом называется радиус, равный минимальному расстоянию, на которое центр сферы данного атома может приблизиться к поверхности сфер соседних атомов.
Для определения межядерных расстояний используется рентгеноструктурный анализ или метод электронографии, основанный на дифракции электронов, микроволновая спектроскопия и др.
Величина радиуса атома сильно зависит от способа его оценки. Поэтому различают, например, ковалентный, ионный, металлический, ван-дер-ваальсов радиус.
Радиус атомов металлов несложно получить, зная параметры кристаллических решеток металлов, т.к. речь идет об одинаковых атомах. Однако, определяемые размеры атомов одного и того же металла могут отличаться для разных типов кристаллических решеток.
Ван-дер-ваальсовы радиуса определяют в отсутствии химического взаимодействия, например, для инертных газов.
Ионные радиусы получают путем анализа решеток ионных кристаллов. При определении радиусов приходиться учитывать не только большую разницу в размерах анионов и катионов, но и их взаимное расположение.
Ковалентный радиус определяется из межъядерного расстояния между двумя атомами, связанными друг с другом ковалентной связью.
Радиусы атомов и ионов в соединениях часто определяют по разности межъядерного расстояния и известного радиуса одной из частиц. Например, если разными методами установлено, что ионный радиус иона F– составляет 0,133 нм, а межядерное расстояние согласно рентгенограмме кристалла NaF равно 0,231 нм, то радиус иона Na+ составит 0, 098 нм. Аддитивные методы расчета применимы к весьма ограниченному кругу кристаллов и ковалентных соединений. Так, в случае двойных и тройных ковалентных связей расстояние между атомами заметно уменьшается.
Квантово-механические расчеты размеров атомов, позволяющие оценить область, где находится 90% их электронной плотности хорошо коррелируют с величинами, определенными экспериментально.
Независимо от методики определения, взаимное отношение величин радиусов атомов и ионов различных элементов остается неизменным. В периоде радиус атомов уменьшается за счёт увеличения заряда ядра и роста притяжения внешней электронной оболочки к ядру. С увеличением номера периода атомные радиусы растут из-за увеличения числа электронных слоев.
Самые большие значения принадлежат анионным и ван-дер-ваальсовым радиусам. Катионы имеют меньшие размеры, чем атомы, а анионы – большие размеры, чем атомы этих же элементов. Для каждого элемента из всех типов радиусов наименьшее значение всегда принадлежит катионному радиусу.
К основным характеристикам атома, оказывающих определяющее влияние на химические свойства относятся энергия ионизации, энергия сродства к электрону и электроотрицательность.
Энергия ионизации Е и– представляет собой наименьшую энергию, необходимую для удаления электрона от свободного атома, находящегося в его основном состоянии, на бесконечность.
А0 – е ® А+
Измеряется Е и обычно в электрон-вольтах или джоулях на моль. Из графика на рисунке 21 видно, что Е и периодически изменяется с ростом заряда ядра Z, что определяется зарядом ядра и электронной конфигурации атома. С ростом заряда ядра энергия ионизации увеличивается за счет кулоновского притяжения. В то же время, с увеличением числа происходит рост числа электронных оболочек, что приводит к увеличению радиального расстояния от ядра до удаляемого при ионизации электрона и росту экранирования положительного заряда.
Максимумы энергии ионизации приходятся на элементы с устойчивой электронной конфигурацией – s2 ,p3,p6,d10... а минимумы – на неустойчивые – s1,p1,p4.
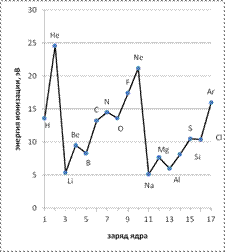
Рисунок 21. Зависимость энергии ионизации атома от заряда ядра
Сродство атома к электрону – способность атомов присоединять электрон и превращаться в отрицательный ион.
A0 + e ® A–
Мерой сродства к электрону служит энергия, которая при этом выделяется или поглощается – Е ср..
Наибольшим сродством к электрону обладают p -элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s 2 (Be, Mg, Zn) и s 2 p 6 (Ne, Ar) или с наполовину заполненными p -орбиталями (N, P, As) (рис.21).
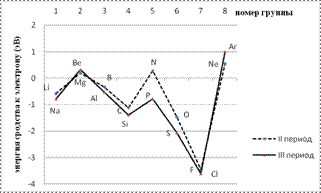
Рисунок 22. Зависимость энергии сродства к электрону от номера группы для элементов II иIII периода
Электроотрицательность (χ) – количественная характеристика способности атома в молекуле смещать к себе электронную плотность (общие электронные пары).
Понятие об электроотрицательности было введено Лайнусом Полингом в 1932 году. Полинг отметил, что для любой пары атомов АВ энергия простой связи А—В обычно больше, чем среднее из энергий простых связей А—А и В—В. Дополнительное взаимодействие Полинг объяснил возникновением ионной составляющей связи. Этот ионный характер связи АВ увеличит ее энергию по сравнению с тем, что ожидалось в случае чисто ковалентной связи. Используя термодинамические данные и приняв величину электроотрицательности для водорода χ =2,1, Полинг определил коэффициенты электроотрицательности для других элементов. В шкале относительных атомных электроотрицательностей Полинга францию соответствует наименьшее значение – 0,7, а атому фтора наибольшее – 4,0. Фтор является наиболее электроотрицательным элементом, за ним следует кислород, азот, хлор и другие галогены. Щелочные и щелочноземельные металлы имеют наименьшие значения электроотрицательности. Существуют другие шкал электроотрицательности, в основу которых положены разные свойства веществ. Но относительное расположение элементов в них примерно одинаково.
Роберт Малликен ввёл представление об электроотрицательности атома, как о средней величине энергии связи внешних электронов при ионизации валентных состояний (например, от А− до А+) и на этой основе предложил соотношение:
χ = ½(Е и + Е ср), где Е и и Е ср– соответственно энергия ионизации атома и его сродство к электрону.
Шкалы, построенные на результатах различных методов, не противоречивы и хорошо согласуются друг с другом, за исключением относительно небольших различий.
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Она зависит от валентного состояния атома, формальной степени окисления, типа связи, и от многих других факторов.
Периодическая таблица Д.И.Менделеева
Радиус, энергия ионизации и сродство к электрону, электроотрицательность являются следствием заряда ядра электронного строения атома. Следовательно, электронное строение предопределяет химическое поведение элементов при взаимодействии друг с другом. Химические свойства элементов, наряду с атомным весом легли в основу Периодического закона и Периодической системы Дмитрия Ивановича Менделеева.
Современная формулировка периодический закон отличается лишь тем, что свойства элементов и их соединений ставятся в зависимости от заряда ядра и, как следствие, электронного строения.
Рекомендуемым IUPAC вариантом периодической таблицы в настоящее время является ее длиннопериодный вариант.
В каждом периоде происходит постепенное заполнение внешнего электронного уровня, характеризуемого главным квантовым числом n. Периоды располагаются в параллельных строках так, чтобы элементы с одинаковым строением внешнего уровня, а следовательно, схожими свойствами, располагаются друг под другом, образуя 18 групп. Два ряда f -элементов выносятся за пределы основной таблицы.
Элементы, имеющие в качестве валентных электронов только s -электроны, называются s -элементами (например, литий, кальций). Элементы, имеющие в качестве валентных s - и р - электроны, являются р -элементами (например, азот и фтор). Элементы с валентными s - и d -электронами d -элементы (скандий и молибден) а с s - и f -электронами – f -элементы (уран, лантан). Каждый вид электронного заполнения выделен в таблице особым цветом, что позволяет проще ориентироваться.
В начале каждого периода, расположены элементы, имеющие небольшую энергию ионизации – водород и щелочные металлы. Они легко отдают электроны, являются сильными восстановителями. С повышением заряда ядра в каждом периоде восстановительные свойства элементов снижаются. Галогены, имеющие почти заполненные р- оболочки – сильные окислители. Инертные газы, отнесенные в крайне правый столбец таблицы, обладающие полностью заполненными электронными оболочками – химически пассивны.
Периодичность изменения свойств состоит в их постепенном изменении в периодах и рядах, резком изменении при переходе к новому периоду и повторению в нем свойств элементов предшествующего периода.
 2018-01-08
2018-01-08 1540
1540
