В общем виде реакция выглядит следующим образом:
 (42)
(42)
Уравнение для скорости реакции запишется в виде:
 (43)
(43)
Рассмотрим наиболее простой случай, когда число молей исходных веществ в начальный момент времени t = 0 равно а, а число молей продуктов реакции равно нулю. Тогда выражение (32) будет выглядеть так:
 (44)
(44)
Сокращаем на V, получаем:
 (45)
(45)
 (46)
(46)
Раскрывая скобки и вынося за скобки k1 – k2:
 (47)
(47)
Выражение в квадратных скобках можно представить как произведение двух двучленов:
 (48)
(48)
где m1, m2 – корни квадратного уравнения, получаемого, если приравнять к нулю трёхчлен в квадратных скобках в выражении (47).
Найдём корни квадратного уравнения, стоящего в квадратных скобках в уравнении (47), которое можно представить в следующем виде:
 (49)
(49)
где  – константа равновесия.
– константа равновесия.
Значение дискриминанта D:

 (50)
(50)
Корни уравнения будут находиться по формуле:
 (51)
(51)
Решая уравнение (48) аналогично бимолекулярному уравнению (22) получаем:
 (52)
(52)
Значения констант порознь можно найти, исходя из выражения К.
Параллельная реакция
В общем виде реакция выглядит следующим образом:
 (53)
(53)
Пусть а начальное количество вещества А, а х – количество прореагировавшего вещества к моменту времени t. Общая скорость превращения вещества А запишется:
 (54)
(54)
 (55)
(55)
Запишем скорости образования веществ В и D. Пусть концентрация образовавшегося вещества В к моменту времени t будет y, а D – z. Тогда получаем:
 (56)
(56)
 (57)
(57)
Общая скорость превращения вещества А по двум направлениям:
 (58)
(58)
Подставляя выражения (56), (57) в (58), находим:
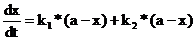 (59)
(59)
или
 (60)
(60)
Сравнивая уравнение (60) с уравнением для мономолекулярной реакции (13), видим, что различие сводится к тому, что в уравнении (60) в левой части стоит сумма констант скоростей обеих параллельных реакций. В случае трёх параллельных мономолекулярных реакций в левой части уравнения будет стоять сумма трёх констант.
Для случая двух параллельных необратимых бимолекулярных реакций получаем уравнение:
 (61)
(61)
После интегрирования имеем (сравнить с уравнением (24)):
 (62)
(62)
Уравнения (60) и (62) дают возможность определить сумму констант скоростей. Если возникает необходимость рассчитать каждую константу, то нужно иметь ещё одно уравнение, в которое входили бы эти константы. Покажем на примере двух параллельных необратимых мономолекулярных реакций. Разделив (56) на (57), имеем:
 (63)
(63)
Интегрирование этого уравнения в пределах от 0 до y и соответственно от 0 до z даёт:
 (64)
(64)
Определив в какой-нибудь момент времени количества вещества В и D (y и z), найдём отношение констант скоростей обеих параллельных реакций, затем, решая (64) совместно с (60) получим возможность рассчитать каждую константу порознь.
 2018-01-08
2018-01-08 706
706








