Эквивалент - реальная или условная частица вещества, которая эквивалентна по химическому действию одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
Масса одного моль эквивалентов вещества называется молярной эквивалентной массой вещества.
Из существа понятий о химическом эквиваленте вытекает закон эквивалентов: вещества взаимодействуют в количествах, равных их эквивалентам или массы участвующих веществ пропорциональны молярным массам их эквивалентов
Математическое выражение закона имеет вид:
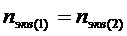 . (1)
. (1)
Это же выражение можно записать в другом виде:
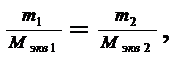 (2)
(2)
где m1, m2 – массы веществ; Мэкв1, Мэкв2 – молярные массы эквивалентов веществ.
Эквивалент вещества может иметь разные значения, что зависит от реакции, в которой участвует вещество.
Для экспериментального определения молярной массы эквивалентов используют следующие методы:
1. Метод прямого определения. Молярная масса эквивалента определяется из данных прямого синтеза кислородного или водородного соединения данного элемента.
|
|
|
2. Аналитический метод. Производится точный анализ соединения данного элемента с любым другим, эквивалент которого известен.
3.Метод вытеснения водорода. Метод применяется для определения молярной массы эквивалентов металлов, способных вытеснять водород из разбавленных кислот и щелочей. Эквивалент определяется из отношения веса данного элемента к весу или объему вытесненного им водорода.
4. Электрохимический метод. Определяется весовое количество элемента, осаждающееся на электроде при электролизе соли данного элемента. (Эквивалент рассчитывается по закону Фарадея).
5. Теоретический метод. Химический эквивалент можно вычислить, зная атомный вес и валентность элемента: 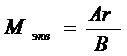 , (3)
, (3)
где Ar – атомная масса, В – валентность.
 2018-01-08
2018-01-08 1705
1705
