Основные положения молекулярно-кинетической теории и их опытное обоснование
Основные положения молекулярно-кинетической теории (МКТ) вещества состоят в следующем:
1)Все вещества состоят из мельчайших частиц: молекул, атомов, ионов и др.
Молекула — мельчайшая частица вещества, способная к самостоятельному существованию и сохраняющая некоторые его свойства. Молекулы, образующие данное вещество, совершенно одинаковы; различные вещества состоят из различных молекул. В природе существует чрезвычайно большое количество различных молекул. Молекулы состоят из более мелких частиц - атомов.
Атомы — мельчайшие частицы химического элемента, сохраняющие его химические свойства. Число различных атомов сравнительно невелико и равно числу химических элементов (105) и их изотопов (около 1500). Атомы представляют собой весьма сложные образования, но классическая МКТ рассматривает их как твердые неделимые частички сферической формы, взаимодействующие между собой по законам механики.
Доказательством молекулярного строения вещества является диффузия, распространение запахов, при котором отдельные молекулы раздражают центры обоняния, а также фотографии молекул, полученные с помощью электронного микроскопа и ионного проектора.
2)Молекулы находятся на определенных расстояниях друг от друга.
Доказательством этого является возможность сжатия твердых тел и растворения одних веществ в других.
Величина этих расстояний зависит от степени нагретости тела и агрегатного состояния вещества.
3)Молекулы связаны друг с другом силами молекулярного взаимодействия - притяжения и отталкивания.
Эти силы зависят от расстояния между частицами (см.ниже, 6.4).
Опытным доказательством этого положения является трудность сжатия и растяжения твердых и жидких тел.
4)Молекулы находятся в непрерывном беспорядочном (тепловом) движении.
Характер теплового движения (поступательное, колебательное, вращательное) молекул зависит от характера их взаимодействия и изменяется при переходе вещества из одного агрегатного состояния в другое. Интенсивность теплового движения зависит от степени нагретости тела, характеризуемой абсолютной температурой. Доказательством этого положения является броуновское движение, диффузия, распространение запахов, испарение веществ и др. В настоящее время МКТ обоснована не какими-то отдельными экспериментами, а успешным развитием и применением на практике больших разделов физики и химии, использующих основные представления МКТ.
Диффузия
Диффузия — самопроизвольное взаимное проникновение молекул соприкасающихся веществ. При диффузии молекулы одного тела, находясь в непрерывном движении, проникают в промежутки между молекулами другого соприкасающегося с ним тела и распределяются между ними. В одном и том же неоднородном веществе вследствие движения молекул концентрация вещества выравнивается — вещество становится однородным.
Диффузия проявляется во всех телах — в газах, жидкостях и твердых телах, — но в разной степени. Диффузию в газах можно наблюдать, если, например, сосуд с пахучим газом открыть в помещении. Через некоторое время газ распространится по всему помещению.
Диффузия в жидкостях происходит значительно медленнее, чем в газах. Например, если в стакан налить сначала слой раствора медного купороса, а затем очень осторожно добавить слой воды и оставить стакан в помещении с неизменной температурой, где бы он не подвергался никаким сотрясением, то через некоторое время исчезнет резкая граница между купоросом и водой, а через несколько дней жидкости перемешиваются, несмотря на то, что плотность купороса больше плотности воды.
Диффузия в твердых телах происходит еще медленнее, чем в жидкостях (от нескольких, часов до нескольких лет). Она может наблюдаться только в хорошо отшлифованных телах, когда расстояние между поверхностями отшлифованных тел близки к расстоянию между молекулами (10~8 см). При этом скорость диффузии увеличивается при повышении температуры и давления.
Броуновское движение открыто в 1827 г. английским ботаником Р.Броуном, теоретическое обоснование с точки зрения МКТ дано в 1905 г. aaЭйнштейном и Смолуховским.
Броуновское движение — это беспорядочное движение мельчайших твердых частиц "взвешенных" в жидкостях (газах).
"Взвешенные" частицы — это частицы, распределенные по объему жидкости, не оседающие на дно и не всплывающие на поверхность жидкости.
Для броуновского движения характерно:
1) броуновские частицы совершают непрерывное хаотическое движение, интенсивность которого зависит от температуры и от размеров броуновской частицы;
2) траектория движения броуновской частицы очень сложная, не зависит от природы частиц и внешних условий.
3) Броуновское движение наблюдается в жидкостях и газах. Причинами броуновского движения являются:
1) хаотическое движение молекул среды 2)Нескомпенсированость ударов малекул на данную частичу Броуновское движение свидетельствует, что молекулы действительно существуют и что они непрерывно и хаотически движутся.
Масса молекул
Измерить массу молекулы обычным путем, т.е. взвешиванием, конечно, невозможно. Она для этого слишком мала. В настоящее время существует много методов определения масс молекул, в частности - с помощью масс-спектрографа. С их помощью определены массы то всех атомов таблицы Менделеева.
Так, для изотопа углерода 12/6* С т0= 1,995 ■ 10~26 кг.
Поскольку массы атомов и молекул чрезвычайно малы, то при расчетах обычно используют не абсолютные, а относительные значения масс, получаемые путем сравнения масс атомов и молекул с атомной единицей массы, в качестве которой выбрана 1/12 часть массы атома углерода 1 а.е.м. = 1/12 *т 0C= 1,660 • 10'27 кг.
Относительной молекулярной (или атомной) массой М r
называют величину, показывающую, во сколько раз масса молекулы (или атома) больше атомной единицы массы. Относительная молекулярная (атомная) масса является безразмерной величиной.
Относительные атомные массы всех химических элементов указаны в таблице. Относительная молекулярная масса данного вещества равна сумме относительных атомных масс элементов, входящих в состав данного вещества. Ее рассчитывают, пользуясь таблицей Менделеева и химической формулой вещества.
Так, для воды (Н2О) М r= 1*2 + 16 = 18.
Количество вещества. Постоянная Авогадро
Количество вещества, содержащегося в теле, определяется числом молекул (или атомов) в этом теле. Поскольку число молекул в макроскопических телах очень велико, для определения количества вещества в теле сравнивают число молекул в нем с числом атомов в 0,012 кг углерода.
Количество вещества υ — величина, равная отношению числа молекул (атомов) N в данном теле к числу атомов NА в 0,012 кг углерода. υ=N/Na [υ]=1моль; υ=m/M
1 моль — количество вещества, содержащее столько же структурных элементов (атомов, молекул, ионов), сколько содержится атомов в 0,012 кг углерода 12/6*С.
Число молекул в одном моле вещества --- постоянной Авогадро
Na=0.012/m0C; Na=6.02*1023моль-1
Масса вещества, взятого в количестве 1 моля -- молярной массой М.
M=m0N;[M]=1кг/моль;M=Mr*103; N=υNa-число малек;m0=M/Na-мас.1 малек; m=m0N=m0υNa=υM
Размеры молекул
Размер молекулы является величиной условной. Между молекулами наряду с силами притяжения действуют и силы отталкивания, поэтому молекулы могут сближаться лишь до некоторого расстояния.
Расстояние предельного сближения центров двух молекул называют эффективным диаметром молекулы d (при этом считают, что молекулы имеют сферическую форму).
Метод определения размеров малек:
В твердых и жидких телах молекулы расположены очень близко одна к другой, почти вплотную. Поэтому можно считать, что V, занимаемый телом некоторой массы т, приблизительно = сумме объемов всех его молекул.V1=V/N; N=m/M*Na;V1=VM/mNa;
ρ=m/V-плотность тела. малекула—шар, то d=2r; V1=4/3πr^3=πd^3/6;
d= 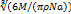 ; Размеры молекул очень малы.
; Размеры молекул очень малы.
Идеальный газ
Форму и объем тела определяет совместное действие двух факторов: 1) взаимодействие молекул, которое стремится удержать молекулы на определенных расстояниях друг от друга; 2) хаотическое движение молекул, которое разбрасывает их по всему объему.
Молекулы газа разлетаются по всему предоставленному для него объему. Следовательно, главную роль в поведении газа играет хаотическое движение молекул, а силы взаимодействия малы, и ими можно пренебречь. Это означает, что молекулы газа движутся равномерно и прямолинейно, пока не столкнутся с другими молекулами. При столкновении изменяется величина и направление скорости движения молекулы, и она снова движется равномерно прямолинейно до следующего столкновения. Длина свободного пробега (расстояние между двумя последовательными столкновениями молекулы) X ~ 10~7 м. При такой длине свободного пробега только 0,04% пространства, занятого газом, приходится на собственный объем его молекул. Это дает право воспользоваться моделью идеального газа.
Идеальный газ — это газ с достаточно простыми свойствами:
1) молекулы его исчезающе малы и их собственным объемом можно пренебречь, по сравнению с объемом сосуда, в котором находится газ;
2) между молекулами идеального газа нет сил взаимодействия;
3) молекулы идеального газа ведут себя при столкновениях как абсолютно упругие шарики.
При небольших давлениях и не очень низких температурах реальные газы близки к идеальному газу.При высоких давлениях молекулы газа сближаются, что пренебречь их собственным объемом нельзя и между ними возникают заметные силы притяжения.При низких температурах кинетическая энергия уменьшается и становится сравнимой с потенциальной энергией и пренебречь последней нельзя.
Для описания свойств газов можно пользоваться:1) микроскопическими параметрами (скорость, масса молекулы, ее энергия и др.), которые являются индивидуальными характеристиками молекул и численные значения которых находятся только расчетным путем; 2) макроскопическими параметрами (давление, температура, объем газа), значение которых определяется совместным действием огромного числа молекул. Макропараметры — это параметры газа как физического тела. Численные значения их находят простым измерением с помощью приборов.
Давление газа — это средняя сила ударов молекул о тело (например, о стенки сосуда), отнесенная к единице его поверхности.
Абсолютная температура Т — мера средней кинетической энергии хаотического движения молекул (см. раздел 6.11).
Под объемом газа понимают объем сосуда, в котором находится газ.
 2018-01-08
2018-01-08 1531
1531