Представление об атомах как неделимых («атомос» - неделимый) мельчайших частицах вещества возникло еще в античные времена, но только в XVIII веке трудами А. Лавуазье, М. В. Ломоносова и других ученых была доказана реальность существования атомов. Но вопрос об их внутреннем устройстве даже не возникал, и атомы по-прежнему считались неделимыми частицами. В XIX веке изучение атомистического строения вещества существенно продвинулось вперед. В 1833 году при исследовании явления электролиза М. Фарадей установил, что ток в растворе электролита это упорядоченное движение заряженных частиц – ионов. Фарадей определил минимальный заряд иона, который был назван элементарным электрическим зарядом (e = 1,60·10–19 Кл).
На основании исследований Фарадея можно было сделать вывод о существовании внутри атомов электрических зарядов.
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Д. И. Менделеев, разработавший в 1869 году периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов.
Важным свидетельством сложной структуры атомов явились спектроскопические исследования, которые привели к открытию линейчатых спектров атомов. В начале XIX века были открыты дискретные спектральные линии в излучении атомов водорода в видимой части спектра, и впоследствии были установлены математические закономерности, связывающие длины волн этих линий (И. Бальмер, 1885 г.).
В 1896 году А. Беккерель обнаружил явление испускания атомами невидимых проникающих излучений, названное радиоактивностью. В последующие годы явление радиоактивности изучалось многими учеными (М. Склодовская-Кюри, П. Кюри, Э. Резерфорд и др.). Было обнаружено, что атомы радиоактивных веществ испускают три вида излучений различной физической природы (альфа-, бета- и гамма-лучи). Альфа-лучи оказались потоком ионов гелия. Бета-лучи – потоком электронов, а гамма-лучи – потоком квантов жесткого рентгеновского излучения.
В 1897 году Дж. Томсон открыл электрон и измерил отношение e / m заряда электрона к массе. Опыты Томсона подтвердили вывод о том, что электроны входят в состав атомов.
Таким образом, на основании всех известных к началу XX века экспериментальных фактов можно было сделать вывод о том, что атомы вещества имеют сложное внутреннее строение. Они представляют собой электронейтральные системы, причем носителями отрицательного заряда атомов являются легкие электроны, масса которых составляет лишь малую долю массы атомов. Основная часть массы атомов связана с положительным зарядом.

Рис. 1. Модель атома Дж. Томсона.
Первая попытка создания модели атома на основе накопленных экспериментальных данных принадлежит Дж. Томсону (1903 г.). Он считал, что атом представляет собой электронейтральную систему шарообразной формы радиусом примерно равным 10–10 м. Положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся внутри него. Через несколько лет в опытах великого английского физика Э. Резерфорда было доказано, что модель Томсона неверна.

Рис. 2. Схема опыта Резерфорда по рассеянию α-частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп.
Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Э. Резерфордом 1909–1911 годах. Резерфорд применил зондирование атома с помощью α-частиц. Масса α-частиц в 7300 раз больше массы электрона, а положительный заряд равен 2 e. Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц велика – порядка 107 м/с,).

Рис. 3. Рассеяние α-частицы в атоме Томсона (a) и в атоме Резерфорда (b).
Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Эти результаты были неожиданными даже для Резерфорда и привели его к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла ядерная модель атома.

Рис. 4. Планетарная модель атома Резерфорда. Показаны круговые орбиты четырех электронов.
Опыты Резерфорда привели к выводу, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10–14–10–15 м. Это ядро занимает только 10–12 часть полного объема атома, но содержит весь положительный заряд и не менее 99,95 % его массы. Веществу, составляющему ядро атома, следовало приписать колоссальную плотность порядка ρ ≈ 1015 г/см3. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома.
Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, вращаются под действием кулоновских сил со стороны ядра электроны. Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро. Однако планетарная модель атома оказалась неспособной объяснить факт длительного существования атома, т. е. его устойчивость. По законам классической электродинамики, движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию.


 (1)
(1)
За короткое время (порядка 10–8 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.
Простейшим из атомов является водород. Он содержит единственный электрон. Ядром атома является протон – положительно заряженная частица, заряд которой равен по модулю заряду электрона, а масса в 1836 раз превышает массу электрона. Еще в начале XIX века были открыты дискретные спектральные линии в излучении атома водорода в видимой области (линейчатый спектр). Впоследствии закономерности, которым подчиняются длины волн (или частоты) линейчатого спектра, были хорошо изучены количественно (И. Бальмер, Швейцария, 1885 г.). Совокупность спектральных линий атома водорода в видимой части спектра была названа серией Бальмера. Позже аналогичные серии спектральных линий были обнаружены в ультрафиолетовой и инфракрасной частях спектра. В 1890 году И. Ридберг получил эмпирическую формулу для частот спектральных линий:
 , т = 1, 2, 3, 4, 5, 6; n = m +1, m +2,… (1)
, т = 1, 2, 3, 4, 5, 6; n = m +1, m +2,… (1)
где R = 3,29×1015 с-1 – постоянная Ридберга. Для серии Бальмера в видимом свете m = 2, n = 3, 4, 5,.... Для ультрафиолетовой серии (серия Лаймана) m = 1, n = 2, 3, 4,.... До Бора механизм возникновения линейчатых спектров и смысл целых чисел, входящих в формулы спектральных линий водорода оставались непонятными.
Датский физик Нильс Бор в 1913 г. предпринял смелую попытку объяснить результаты анализа спектра атома водорода. Это была первая попытка построить качественно новую (квантовую) теорию атома.
50.
Теория атома водорода по Бору
В качестве последнего примера безуспешных попыток классической физики дать полную теорию физических явлений рассмотрим атом водорода.
Согласно классической модели Резерфорда атом водорода состоит из одного электрона, вращающегося вокруг положительно заряженного малого атомного ядра. Эта классическая модель не смогла объяснить два основных экспериментальных факта:
а) стабильность атома водорода
б) структуру излучаемого им электромагнитного спектра.
В основу теории, исходящей из ядерной модели атома и объясняющей его основные опытные свойства и, прежде всего устойчивость и дискретный спектр излучения, Н. Бор положил два постулата (принципа):
1. Постулат стационарных состояний3 (орбит) – в атоме существуют некоторые особые стационарные состояния, находясь в которых электрон вращается вокруг ядра по круговым орбитам и не излучает, хотя и движется с ускорением (центростремительным). Этим постулатом Бор, не покушаясь на справедливость теоретических основ классической физики, допускает исключение из общего правила в виде особых состояний атома с круговыми орбитами электрона в них.
Бор установил (догадкой) правило определения стационарных круговых орбит электрона – так называемое правило квантования орбит. Оно утверждает необходимость целочисленностив постоянных Планка  момента импульса L электрона на этих орбитах, т. е.: L = mur = n
момента импульса L электрона на этих орбитах, т. е.: L = mur = n  , где m иu – масса и скорость электрона, r – радиус его орбиты, n – номер орбиты;
, где m иu – масса и скорость электрона, r – радиус его орбиты, n – номер орбиты;  - постоянная Планка.
- постоянная Планка.
Правило частот. Излучение и поглощение энергии атомом происходит при переходе его из одного стационарного состояния в другое (при переходе электрона с одной стационарной орбиты на другую4). Частота излучения (поглощения) определяется из условия энергетического баланса:  , где
, где  и
и  - энергии электрона на m - ой и n - ой орбитах, соответственно.
- энергии электрона на m - ой и n - ой орбитах, соответственно.
Процесс обратный излучению заключается в поглощении фотона с частотой nnm. В этом случае атом переходит из состояния с меньшей энергией в состояние с большей энергией.
Д


искретность, квантованность энергетических уровней электрона в атоме (и атома в целом), гипотетически постулируемая Бором, получила свое убедительное экспериментальное подтверждение в опыте Франка и Герца в 1913 г. Пропуская электрический ток через лампу - триод, наполненную парами ртути, они обнаружили провалы на вольтамперной характеристике I(U). Эти провалы, т. е. снижения силы тока при некоторых значениях напряжения между анодом А и сеткой С, были объяснены ими как результат неупругого соударения носителей тока – электронов с атомами ртути5. Сетка С, на которую подавался небольшой, порядка 0,5 В положительный потенциал относительно анода, «перехватывала» «ослабевшие» электроны, потерявшие свою кинетическую энергию в результате неупругих соударений с атомами ртути. Соответственно на анод попадало меньше электронов, что проявляло себя в уменьшении анодного тока. Атомы ртути могли воспринять (забрать) от электронов лишь определенную энергию, кратную энергии их возбуждения. При этом атомы ртути переходят в возбужденные состояния, отстоящие от основного по энергии на 4,9 эВ; 6,7 эВ; 10,3 эВ…. Это говорит о том, что энергия атома ртути обладает дискретным спектром значений.
В математическом плане Бор при построении теории простейшего атома – атома водорода, отталкивался от двух уравнений для электрона в атоме. Одно из них было чисто классическим, представляя собой, второй закон Ньютона с кулоновской силой (центростремительной), а другое – чисто квантовым – уравнение для момента импульса электрона (правило квантования орбит). Отсюда следовал вывод о непоследовательности теории Бора, которая была уже не чисто классической, но не была еще и последовательно квантовой. Такая непоследовательность обусловила значительную ограниченность теории Бора, ее предсказательных возможностей.
Запишем и решим систему из двух уравнений для электрона в атоме с порядковым номером Z. Напомним, что у Бора Z = 1, что соответствовало атому водорода.
 здесь
здесь 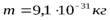 ;
;  ;
;  ;
;
n = 1, 2, 3, … - номера орбит.
Имеем систему двух уравнений с двумя неизвестными u и r. Избавимся от u, возведя второе уравнение в квадрат  и поделив его на первое, в котором сократим r:
и поделив его на первое, в котором сократим r:
 Þ
Þ  =
=  .
.
П

олученное выражение для радиуса орбиты электрона в атоме указывает на дискретный, квантовый характер его значений. Для n = 1 и Z = 1 значение радиуса первой (невозбужденной) орбиты r1 = 0,53×10-10 м - хорошо совпадает с размером атома водорода.
Скорость электрона также квантуется:
 , причем un ~ 1/n.
, причем un ~ 1/n.
Полная энергия электрона в атоме складывается из суммы кинетической и потенциальной:  ;
;
 - энергия взаимодействия двух, разных по знаку, точечных зарядов – электрона и ядра.
- энергия взаимодействия двух, разных по знаку, точечных зарядов – электрона и ядра.
Для u<< с:  ;
; 
Полученное выражение для полной энергии электрона в атоме содержит набор отрицательных значений; это является свидетельством связанности состояния электрона в атоме – энергия связи (отрицательная) превышает энергию движения (положительную). При возрастании полной энергии до нуля электрон оказывается свободным, а атом ионизированным.
С

ростом номера и радиуса орбиты полная энергия электрона возрастает, оставаясь до уровня ионизации отрицательной. При n®¥ и  Þ E = 0 – электрон отрывается от ядра, а атом превращается в положительный ион.
Þ E = 0 – электрон отрывается от ядра, а атом превращается в положительный ион.
Подставляя в выражение для полной энергии электрона ранее выражение для радиуса его орбиты, получаем формулу для полной энергии электрона:  . Полная энергия Е электрона в атоме квантуется, т. е. имеет дискретный спектр.
. Полная энергия Е электрона в атоме квантуется, т. е. имеет дискретный спектр.
Для n = 1 (атом водорода)  » -13,6 эВ;
» -13,6 эВ;  ;
;  ; … Е¥ = 0.
; … Е¥ = 0.
Энергетические уровни атома с ростом номера уровня сгущаются, и при n ®¥ изменение энергии атома происходит почти непрерывно. Имеем переход к классической физике, выражаемый принципом соответствия6 Бора.
Разность энергий электрона на втором и первом энергетических уровнях называется энергией  возбуждения атома: Ев = Е2 – Е1. Энергии возбуждения соответствует потенциал возбуждения Vв: Е = qеVв. Для водорода Ев = 10,2 эВ и Vв = 10,2 В.
возбуждения атома: Ев = Е2 – Е1. Энергии возбуждения соответствует потенциал возбуждения Vв: Е = qеVв. Для водорода Ев = 10,2 эВ и Vв = 10,2 В.
Разность энергий на бесконечно удаленной от ядра и первой орбитах называется энергией  ионизации, т. е. отрыва электрона от атома; для водорода Еi = Е¥ – Е1 = - Е1 = 13,6 эВ.
ионизации, т. е. отрыва электрона от атома; для водорода Еi = Е¥ – Е1 = - Е1 = 13,6 эВ.
Энергия фотона, излучаемого при переходе электрона с m - ой на n - ую орбиты может быть записана в виде: Е = Еi(1/n2 – 1/m2).
 2018-01-08
2018-01-08 1702
1702








