Вытекающая из теории Бора дискретная структура энергетических уровней электрона в атоме позволяет объяснить закономерности в спектре излучения атома водорода. Из опыта известно, что спектр теплового излучения невзаимодействующих атомов имеет дискретный характер в виде совокупности отдельных спектральных линий, которые определенным образом упорядочены в некоторые группы, называемые сериями. Такая сериальная упорядоченность спектра излучения атома водорода описывается обобщенной формулой Бальмера:
 , где
, где  и
и  - постоянные Ридберга:
- постоянные Ридберга: 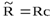 ,
,
n - номер спектральной серии; n = 1, 2, 3 …
m - номер спектральной линии в серии; m = n + 1, m + 2 …
При n = 1; n =  (1 – 1/m2), где m = 2, 3, 4 … - серия Лаймана – лежит в ультрафиолетовом диапазоне.
(1 – 1/m2), где m = 2, 3, 4 … - серия Лаймана – лежит в ультрафиолетовом диапазоне.
n = 2; n =  (1/22 – 1/m2), где m = 3, 4, 5… - серия Бальмера – первые четыре ее линии лежат в
(1/22 – 1/m2), где m = 3, 4, 5… - серия Бальмера – первые четыре ее линии лежат в
видимой области спектра.
n

= 3;n=  (1/32 – 1/m2), где m = 4, 5, 6 … - серия Пашена – лежит в инфракрасной области.
(1/32 – 1/m2), где m = 4, 5, 6 … - серия Пашена – лежит в инфракрасной области.
Наглядное представление механизма образования сериально упорядоченного линейчатого спектра атома водорода дано на схеме.
|
|
|
Теория Бора позволяет просто получить и саму обобщенную формулу Бальмера. Выразим из правила частот Бора  частотуn излучения:
частотуn излучения:
 и, подставив в нее выражение для энергии:
и, подставив в нее выражение для энергии: 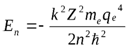 получим:
получим: 
Сравнивая с формулой Бальмера, видим, что постоянная Ридберга  образуется набором фундаментальных физических констант:
образуется набором фундаментальных физических констант:  при Z = 1. Подставляя их значения, получим для
при Z = 1. Подставляя их значения, получим для  значение
значение  , совпадающее с известным из опыта.
, совпадающее с известным из опыта.
Формулу Бальмера часто записывают не для частоты n, а для обратной длины волны 1/l.
Из n = с/lÞ 1/l = n/с = ( /с)(1/n2 – 1/m2) = R(1/n2 – 1/m2), где R =
/с)(1/n2 – 1/m2) = R(1/n2 – 1/m2), где R =  /с =
/с =  .
.
Спектральная линия с наибольшей длиной волны в данной серии называется ее головной линией, а с наименьшей длиной волны – границей серии.
Формула Бальмера оказывается применимой для так называемых водородоподобных атомов. К ним относят ионизованные атомы, имеющие один электрон, например, однократно ионизованный атом гелия Не+(Z = 2) и двухкратно ионизованный атом лития Li++ (Z = 3).
 2018-01-08
2018-01-08 2460
2460
