Тиск суміші хімічно не взаємодіючих ідеальних газів дорівнює сумі парціальних тисків.

Середня кінетична енергія руху частинок залежить від температури.
Середня кінетична енергія руху молекули
 ,
,
де m — маса частинки, v — її швидкість, 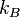 — стала Больцмана, T — температура.
— стала Больцмана, T — температура.
У статистичній фізиці виводиться закон Больцмана про рівномірний розподіл енергії за ступенями свободи молекул: для статистичної системи, яка знаходиться в стані термодинамічної рівноваги, на кожну поступальну і обертальну ступені свободи припадає в середньому кінетична енергія, рівна kT / 2, а на кожну коливальну ступінь свободи - в середньому енергія, рівна kT. Коливальна ступінь має вдвічі більшу енергією, тому на неї припадає як кінетична енергія (як у випадку поступального і обертального рухів), так і потенційна, причому середні значення потенційної і кінетичної і енергії однакові. Значить, середня енергія молекули
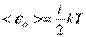 ,
,
де i - Сума числа поступальних, числа обертальних та подвоєного числа коливальних ступенів свободи молекули: i = i пост+ i об+2 i кол
Закон розподілу молекул ідеального газу по швидкостях, теоретично отриманий Максвеллом в 1860 г. визначає, яке число dn молекул однорідного (p = const) одноатомного ідеального газу із загального числа N його молекул в одиниці об'єму має при даній температурі Т швидкості, які лежать в інтервалі від v до v + dv.
Для висновку функції розподілу молекул по швидкостях f(v) рівної відношенню числа молекул dn, швидкості яких лежать в інтервалі v ¸ v + dv до загального числа молекул N і величині інтервалу dv

Максвелл використовував дві пропозиції:
а) усі напрямки в просторі рівноправні й тому будь-який напрямок руху частки, тобто будь-який напрямок швидкості однаково ймовірний. Цю властивість іноді називають властивістю ізотропності функції розподілу.
б) рух по трьом взаємно перпендикулярним осям незалежні тобто х-компоненти швидкості  не залежить від того яке значення її компонентів
не залежить від того яке значення її компонентів  або
або  . тоді висновок f (v) робиться спочатку для одного компонента
. тоді висновок f (v) робиться спочатку для одного компонента 
, а потім узагальнюється на всі координати швидкості.
Уважається також, що газ складається з дуже великого числа N тотожних молекул, що перебувають у стані безладного теплового руху при однаковій температурі. Силові поля на газ не діють.
Функції f (v) визначає відносне число молекул dn(v)/N швидкості яких лежать в інтервалі від v до v + dv (наприклад: газ має N = 106 молекул, при цьому dn = 100 молекул мають швидкості від v до v + dv (наприклад: газ має N = 106 молекул, при цьому dN = 100 молекул мають швидкості від v =100 до v + dv =101 м/с (dv = 1 м  ) тоді
) тоді
 .
.
Використуючи методи теорії ймовірностей, Максвелл знайшов функцію f (v) - закон розподілу молекул ідеального газу по швидкостях:
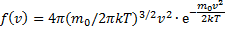
f (v) залежить від роду газу (від маси молекули) і від параметра стану (від температури Т)
f(v) залежить від відношення кінетичної енергії молекули, що відповідає розглянутої швидкості  до величини kТ, що характеризує середню теплову енергію молекул газу.
до величини kТ, що характеризує середню теплову енергію молекул газу.
 2018-01-08
2018-01-08 569
569








