Будь-який рівноважний процес є оборотним.
Оборотні процеси - це до деякої міри ідеалізація реальних процесів. Всі реальні процеси є необоротними.
Уявімо принцип дії циклічних машин. Реальна теплова циклічна машини складається з пічки (нагрівача), холодильника і робочого тіла.
Для теоретичного пояснення роботи теплових машин необхідно знання другого закону термодинаміки в наступному вигляді: неможливо створити циклічно працюючий тепловий двигун, єдиним результатом дії якого отримання від джерела кількості теплоти і перетворення його повністю в механічну енергію.
Визначимо принцип роботи циклічної теплової машини. Робоче тіло, в результаті контакту з нагрівачем, отримує від нього внаслідок обміну теплом деякої кількість теплоти, рівне Q1, нагріваючись до деякої температури T1. Після завершення контакту з нагрівачем, робоче тіло переходить в контакт з холодильником.
При такому переході робоче тіло здійснює механічну роботу A. У контакті з холодильником, робоче тіло віддає йому деяку кількість теплоти Q2 - охолоджується.
Потім робоче тіло знову переходить в контакт з пічкою - процес повторюється.
Цикл Карно́ — ідеальний термодинамічний цикл.
Цикл складається з чотирьох стадій:
- Робоча речовина нагрівається за сталої температури (ізотермічний процес).
- Робоча речовина розширюється за сталої ентропії (адіабатичний процес).
- Робоча речовина охолоджується за сталої температури (ізотермічний процес).
- Робоча речовина стискається за сталої ентропії (адіабатичний процес).
Коефіцієнт корисної дії для двигуна, що працює за циклом Карно, залежить лише від різниці температур нагрівача 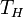 і охолоджувача
і охолоджувача 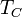 .
.
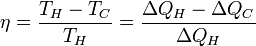
Ентропія - в природничих науках міра безладу системи, що складається з багатьох елементів.
Ентропія є функцією стану і залишається постійною при оборотних процесах, тоді як у необоротних - її зміна завжди позитивна.
Властивості ентропії:
1. Ентропія ізольованої системи при протіканні незворотного процесу зростає. Дійсно, ізольована (тобто надана сама собі) система переходить з менш вірогідних в більш ймовірні стани, що супроводжується зростанням величини S.
2. Ентропія системи, що перебуває в рівноважному стані, максимальна.
Дру́гий закон термодина́міки —закон про неспадання ентропії в ізольованій системі. Він накладає обмеження на кількість корисної роботи, яку може здійснити тепловий двигун. На засадничому рівні другий закон термодинаміки визначає напрямок протікання процесів у фізичній системі - від порядку до безпорядку
Для системи із сталою температурою існує певна функція стану S — ентропія, яка визначається таким чином, що
Адіабатичний перехід із рівноважного стану A в рівноважний стан B можливий лише тоді, коли
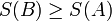 .
.
Статистична фізика вводить нове означення ентропії, на перший погляд дуже відмінне від визначення термодинаміки. Воно задається формулою Больцмана:
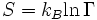 ,
,
де Γ — кількість мікроскопічних станів, які відповідають даному макроскопічному стану, 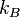 — стала Больцмана.
— стала Больцмана.
Із статистичного означення ентропії очевидно, що зростання ентропії відповідає переходу до такого макроскопічного стану, який характеризується найбільшим значенням мікроскопічних станів.
 2018-01-08
2018-01-08 513
513







