Барометри́чна фо́рмула — формула, за якою визначають залежність тиску або густини газу від висоти. Ця залежність зумовлена дією поля тяжіння Землі і тепловим рухом молекул газу (повітря). Припускаючи, що газ є ідеальним газом сталої температури, і вважаючи поле тяжіння Землі однорідним, отримують барометричну формулу такого вигляду:
 ,
,
де p0 — тиск на нульовому рівні (на рівні вибою в газових свердловинах, біля поверхні Землі або на рівні моря), Па;
p — тиск на висоті h, м над цією поверхнею, Па;
m — маса молекули (для повітря дорівнює масі молекули азоту), кг;
g — прискорення вільного падіння, м/с2;
k — стала Больцмана, Дж/К;
T — абсолютна температура повітря, К.
Больцман довів, що співвідношення  справедливе не тільки у випадку потенціального поля сил земного тяжіння, але і в довільному потенціальному полі сил для сукупності довільних однакових частинок, що знаходяться у стані хаотичного теплового руху. Тому вираз
справедливе не тільки у випадку потенціального поля сил земного тяжіння, але і в довільному потенціальному полі сил для сукупності довільних однакових частинок, що знаходяться у стані хаотичного теплового руху. Тому вираз  називається розподілом Больцмана у зовнішньому потенціальному полі.
називається розподілом Больцмана у зовнішньому потенціальному полі.
Із цього виразу видно, що чим менша потенціальна енергія молекул, тим більша їх концентрація.
Розпо́діл Ма́ксвелла — Бо́льцмана визначає ймовірність того, що частинка ідеального газу перебуває в стані з певною енергією.
Ймовірність того, що частинка перебуває в стані з енергією  згідно з розподілом Больцмана визначається формулою:
згідно з розподілом Больцмана визначається формулою:
 ,
,
де μ — хімічний потенціал, T — температура, kB — стала Больцмана.
Хімічний потенціал μ визначається з умови

де N — число частинок.
Розподіл Больцмана справедливий тільки в тих випадках, коли  . Ця умова реалізується при високих температурах.
. Ця умова реалізується при високих температурах.
Термодинамічна система - це якась фізична система, що складається з великої кількості частинок, здатна обмінюватися з навколишнім середовищем енергією і речовиною. Також зазвичай покладається, що така система підпорядковується статистичним закономірностям. Для термодинамічних систем справедливі закони термодинаміки.
Вн́утрішня ене́ргія тіла — повна енергія термодинамічної системи за винятком її кінетичної енергії як цілого і потенціальної енергії тіла в полі зовнішніх сил. Внутрішня енергія складається з кінетичної енергії хаотичного руху молекул, потенціальної енергії взаємодії між ними і внутрішньомолекулярної енергії.
Внутрішня енергія є однозначною функцією рівноважного стану системи. Це означає, що кожний раз, коли система опиняється в даному рівноважному стані, її внутрішня енергія приймає властиве цьому стану значення, незалежно від передісторії системи. Отже, зміна внутрішньої енергії при переході з одного стану в інший буде завжди дорівнювати різниці значень в цих станах, незалежно від шляху, по якому здійснювався перехід. Внутрішню енергію тіла не можна виміряти напряму. Можна визначити тільки зміну внутрішньої енергії:
 ,
,
де  — кількість теплоти, передана термодинамічній системі,
— кількість теплоти, передана термодинамічній системі,  — робота, виконана над термодинамічною системою[1] або:
— робота, виконана над термодинамічною системою[1] або:
 ,
,
де  , робота виконана термодинамічною системою.
, робота виконана термодинамічною системою.
Кількість теплоти або кількість тепла - фізична величина, яка характеризує процеси обміну енергією між тілами.
Позначається зазвичай літерою Q, має розмірність енергії. В системі СІ вимірюється в Джоулях, проте доволі популярною залишається позасистемна одиниця вимірювання - калорія.
Кількість теплоти, яка передається тілу, або відбирається від тіла в зворотніх рівноважних процесах, можна визначити із першого закону термодинаміки:
 ,
,
де Q - кількість теплоти, отриманої тілом,  - зміна його внутрішньої енергії, A - робота, виконана тілом над іншими тілами.
- зміна його внутрішньої енергії, A - робота, виконана тілом над іншими тілами.
Ро́бота є однією з основних фізичних величин. В механіці елементарна робота визначається як
-
 ,
,
де  — сила, а
— сила, а  — елементарне (нескінченно мале) переміщення.
— елементарне (нескінченно мале) переміщення.
Елементарна робота термодинамічної системи над зовнішнім середовищем може бути обчислено так:
 ,
,
де  — нормаль елементарної (нескінченно малою) майданчики,
— нормаль елементарної (нескінченно малою) майданчики, 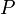 — тиск і
— тиск і  — нескінченно мале збільшення об'єм а.
— нескінченно мале збільшення об'єм а.
Робота в процес  , таким чином, висловлюється так:
, таким чином, висловлюється так:
-
 .
.
Величина роботи залежить від шляху, по якому термодинамічний система переходить зі стану  в стан
в стан  , і не є функцією стану системи. Такі величини називають функціями процесу.
, і не є функцією стану системи. Такі величини називають функціями процесу.
Пито́ма теплоє́мність — характеристика речовини, яка вказує кількість теплоти, необхідної для нагрівання одиниці маси речовини на 1°C, або ж кількість теплоти, що виділяється при охолодженні одиниці маси речовини.
Позначається здебільшого літерою c (для теплоємності тіла будь-якої маси зазвичай використовується велика літера C). В СІ питома теплоємність вимірюється в Дж/кг·К або Дж/кг·°C.
Використовується також поняття молярної теплоємності - це кількість теплоти, яку необхідно надати молю речовини, щоб нагріти його на один градус.
Кількість теплоти, необхідна для нагрівання будь-якого тіла на один градус називається просто теплоємністю тіла.
Молярна теплоємність - це теплоємність одного моля речовини.
Зв'язок з питомою теплоємністю:
 ,
,
де c — питома теплоємність, μ — молярна маса.
Розмірність молярної теплоємності [Дж/(К•моль)]
 2018-01-08
2018-01-08 1101
1101











