Часть 1. Расчет параметров горения и взрыва.
Задача 1
Найти адиабатическую температуру горения стехиометрической смеси 2-метил-2-бутанол с воздухом, начальная температура горючей смеси Т0 = 273К.
Решение.
Адиабатическую температуру горения вещества находят при условии отсутствия теплопотерь (h = 0) для стехиометрической смеси горючего с воздухом, т.е при a = 1.
Запишем уравнение горения 2-метил-2-бутанол с воздухом
С5Н12O +7,5 (О2 + 3,76N2) = 5·CO2 + 6·H2O + 7,5·3,76·N2
Объем продуктов горения составляет:
VCO2 = 5 моль/моль;
VH2O = 6 моль/моль;
V0N2 = 7, 5·3, 76 = 28, 2 моль/моль.
Избыток воздуха VВ = 0, т.к a = 1.
Низшую теплоту сгорания 2-метил-2-бутанол рассчитаем по закону Гесса, взяв значение теплоты образования веществ из табл. II приложения.
QH = 5ΔH0CO2 + 6ΔH0H2O - ΔH0C5H12О = 5·316.6 + 6·242.2 – 330 = 2706,2 кДж/моль.
Так как теплопотери отсутствуют, то все выделившееся тепло идет на нагревание продуктов горения. Среднее теплосодержание продуктов горения будет составлять
HСР= QH = QH = 2706,2 = 69,04 кДж/моль.
∑VПГi VCO2+VH2O+V0N2 5+ 6 + 28,2
С помощью табл. IV приложения, можно установить, какой температуре соответствует такое теплосодержание. Из табл. IV приложения видно, что при температуре 2000оС теплосодержание азота 66,8 кДж/моль. Уточним, сколько потребовалось бы тепла, чтобы нагреть продукты горения до такой температуры.
При Т1 = 2000оС
Q1 = HCO2∙VCO2 + HH2O∙VH2O + HN2∙V0N2,
Q1 = 108,6∙5 + 88,1∙6 + 28,2 ∙66,8 = 2955,36 кДж/моль.
Это больше, чем выделилось тепла в результате реакции горения, Q1 > QH.
Исходя из этого можно сказать, что температура горения меньше, чем 2000оС.
Определим, сколько тепла потребуется для нагревания продуктов горения до 1900оС.
При T2 = 1900oC
Q2 = 102,6∙5 + 82,8∙6 + 28,2 ∙63,1 = 2789,22 кДж/моль.
Так как Q2 > QH, значит ТГ < 1900оC.
При T3 = 1800oC
Q3 = 96,6∙5 + 77,6∙6 + 28,2 ∙59,7 = 2632,14 кДж/моль.
Так как Q3 < QH, из этого можно сделать вывод, что температура горения имеет значение между 1800oC и 1900oC. Уточним эту температуру линейной интерполяцией между двумя этими ближайшими значениями
ТадГ = Т3+ Т2 – Т3 (QH – Q3) = 1800+ 1900 – 1800 (2706,2–2632,14)=
Q2 – Q3 2789, 22 – 2632, 14
= 1847,15оС = 2120,15К.

Ответ: ТАД = 2120,15К.
Задача 2
Определить температуру горения газовой стехиометрической смеси 2-метил-2-бутанол с воздухом, начальная температура горючей смеси Т0 = 273К.
Решение.
Температуру взрыва находят при условии отсутствия теплопотерь (h = 0).
Запишем уравнение горения 2-метил-2-бутанол с воздухом
С5Н12O +7,5 (О2 + 3,76N2) = 5CO2 +6H2O + 7,5∙3,76N2
Объем продуктов горения составляет:
VCO2 = 5 моль/моль;
VH2O = 6 моль/моль;
V0N2 = 7,5∙3,76 = 28,2 моль/моль.
Избыток воздуха VВ = 0, т.к a = 1.
Низшую теплоту сгорания 2-метил-2-бутанол рассчитаем по закону Гесса, взяв значение теплоты образования веществ из табл. II приложения.
QH = 5ΔH0CO2 + 6ΔH0H2O - ΔH0C5H12О = 5∙316.6 + 6∙242.2 – 330 = 2706, 2 кДж/моль.
Так как процесс взрыва адиабатно – изохорный, рассчитаем среднее значение внутренней энергии продуктов взрыва:
UСР= QH = QH = 2706, 2 = 69, 04 кДж/моль.
∑VПГi VCO2+VH2O+V0N2 5+ 6 + 28, 2
С помощью табл. V приложения, можно установить, какой температуре соответствует такое значение внутренней энергии. Из табл. V приложения видно, что при температуре 2600оС внутренняя энергия азота 1 моля составляет 67,4 кДж/моль. Уточним, какое количество теплоты требуется для того, чтобы продукты взрыва нагреть до этой температуры.
При Т1 = 2600оС
Q1 = UCO2∙VCO2 + UH2O∙VH2O + UN2∙V0N2,
Q1 = 123,7∙5 + 97,8∙6 + 28,2∙67,4 = 3105,98 кДж/моль.
Это значительно больше той энергии QH, которая выделилась при взрыве. Поэтому берем другое значение температуры Т2 = 2400оС и определим, какое значение тепла при этой температуре будут содержать продукты взрыва.
При Т2 = 2400оС
Q2 = UCO2∙VCO2 + UH2O∙VH2O + UN2∙V0N2,
Q2 = 113∙5 + 89,7∙6 + 28,2∙61,6=2804,32 кДж/моль.
Это тоже больше, чем количество тепла, выделившегося при взрыве (Q2 > QH), значит, температура взрыва ниже этого значения. Рассчитаем, какое количество тепла содержит продукт взрыва при температуре Т3 = 2300оС.
При Т3 = 2300оС
Q3 = 107,8∙5 + 85,1∙6 + 28,2∙58,7=2704,95 кДж/моль.
Это значение уже меньше, чем QH, значит температура взрыва находится между значениями 2300oC и 2400oC. Уточним значение температуры взрыва методом линейной интерполяции
ТВЗ = Т3+ Т2 – Т3 (QH – Q3) = 2300+ 2400 – 2300 (2706,2 – 2704,95)=
Q2 – Q3 2804,32 –2704,95
= 2301,26оС = 2574,26 К.
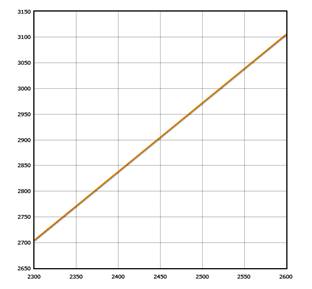
Ответ: ТВЗ = 2574,26 К.
Задача 3
Рассчитать КПР 2-метил-2-бутанол в воздухе. Расчет провести по аппроксимационной формуле.
Решение.
Запишем уравнение горения 2-метил-2-бутанол
С5Н12O +7,5 (О2 + 3,76N2) = 5CO2 +6H2O + 7,5∙3,76N2,
Из уравнения получаем, что n = 7,5.
Рассчитаем нижний концентрационный предел распространения пламени по аппроксимационной формуле, воспользовавшись значениями a и b из табл. 3,
 Н = 100 = 100 = 1,43 %;
Н = 100 = 100 = 1,43 %;
an+ b 8,684∙7,5+4,679
Аналогично рассчитаем верхний концентрационный предел распространения пламени, учитывая, что n = 7,5
 В = 100 = 100 = 8,12 %;
В = 100 = 100 = 8,12 %;
an+ b 0,768∙7,5+6,554
Экспериментальные значения КПР, приводимые в справочной литературе, составляют 1,86 и 8,41 %. Сравнивая их с расчетными убеждаемся, что для 2-метил-2-бутанол расхождение расчетных и экспериментальных данных небольшое.
Ответ:  Н = 1,43 %;
Н = 1,43 %;  В = 8,12%;
В = 8,12%;
Задача 4
Рассчитать значение МФК при разбавлении 2-метил-2-бутанол смеси водяным паром.
Решение.
МФК найдем из условия предельной адиабатической температуры горения стехиометрической 2-метил-2-бутанол смеси, где TГ = 1500 К:
VФ = QН – (ТГ – Т0)∑сPi VПГi
(ТГ – Т0) сPф
Поскольку при этих условиях сгорания идет в основном с образование СО, определим низшую теплоту сгорания 2-метил-2-бутанол для такого случая.
1. Запишем химическое уравнение горения 2-метил-2-бутанол
С5Н12O +2,5 (О2 + 3,76N2) = 5CO +6H2O + 2,5∙3,76N2
Низшая теплота сгорания 2-метил-2-бутанол по закону Гесса
QH = 5ΔH0CO + 6ΔH0H2O - ΔH0C5H12О
QH = 5∙112,7 + 6∙242.2 – 330 = 1686,7 кДж/моль.
2. Составим уравнение материального баланса процесса горения 2-метил-2-бутанол, включив в него и флегматизатор (H2O)
С5Н12O +2,5 (О2 + 3,76N2) = 5CO +6H2O + 2,5∙3,76N2,
VФ = QН – (ТГ – Т0)∙СрCO∙VCO + СрH2O∙VH2O + СрN2∙V0N2
(ТГ – Т0)∙ СрH2O
VCO = 5 моль/моль;
VH2O = 6 моль/моль;
V0N2 = 2,5∙3,76 = 9,4 моль/моль.
VФ = 1686,7 – (1500 – 273)∙3,37∙10-2∙5 + 3,98∙10-2∙6 + 3,18∙10-2∙9,4 =
(1500 – 273)∙ 3,98∙10-2
= 16,79 моль/моль;
3. Запишем уравнение материального баланса для сгорания 2-метил-2-бутанол идеального газа:
С5Н12O +2,5 (О2 + 3,76N2) = 5CO +6H2O + 2,5∙3,76N2,
В исходной горючей смеси (левая часть уравнения) на 1 моль 2-метил-2-бутанол приходится nО2 = 2,5 моль кислорода, nN2 = 2,5∙3,76 моль азота и nФ = 16,79 моль флегматизатора.
4. Рассчитаем МФК паров воды:
 МФК = nФ∙100 = 16,79∙100 = 56,55%.
МФК = nФ∙100 = 16,79∙100 = 56,55%.
nГ + nО2 + nN2 + nФ 1 + 2,5 + 9,4+ 16,79
Ответ:  МФК = 56,55 %.
МФК = 56,55 %.
Задача 5
Рассчитать концентрацию горючего 2-метил-2-бутанол в точке флегматизации.
Решение.
МФК найдем из условия предельной адиабатической температуры горения стехиометрической 2-метил-2-бутанол смеси, где TГ = 1500 К:
VФ = QН – (ТГ – Т0)∙сPi VПГi
(ТГ – Т0) сPф
Поскольку при этих условиях сгорания идет в основном с образование СО, определим низшую теплоту сгорания 2-метил-2-бутанол для такого случая.
1. Запишем химическое уравнение горения 2-метил-2-бутанол
С5Н12O +2,5 (О2 + 3,76N2) = 5CO +6H2O + 2,5∙3,76N2
Низшая теплота сгорания 2-метил-2-бутанол по закону Гесса
QH = 5ΔH0CO + 6ΔH0H2O - ΔH0C5H12О
QH = 5∙112,7 + 6∙242.2 – 330 = 1686,7 кДж/моль.
2. Составим уравнение материального баланса процесса горения 2-метил-2-бутанол, включив в него и флегматизатор (H2O)
С5Н12O +2,5 (О2 + 3,76N2) = 5CO +6H2O + 2,5∙3,76N2,
VФ = QН – (ТГ – Т0)∙СрCO∙VCO + СрH2O∙VH2O + СрN2∙V0N2∙
(ТГ – Т0)∙ СрH2O
VCO = 5 моль/моль;
VH2O = 6 моль/моль;
V0N2 = 2,5∙3,76 = 9,4 моль/моль.
VФ = 1686,7 – (1500 – 273)∙3,37∙10-2∙5 + 3,98∙10-2∙6 + 3,18∙10-2∙9,4 =
(1500 – 273)∙ 3,98∙10-2
= 16,79 моль/моль;
3. Запишем уравнение материального баланса для сгорания 2-метил-2-бутанол идеального газа:
С5Н12O +2,5 (О2 + 3,76N2) = 5CO +6H2O + 2,5∙3,76N2,
В исходной горючей смеси (левая часть уравнения) на 1 моль 2-метил-2-бутанол приходится nО2 = 2,5 моль кислорода, nN2 = 2,5×3,76 моль азота и nФ = 16,79 моль флегматизатора.
4. Рассчитаем концентрацию горючего в точке флегматизации:
 Г(Ф) = nГ∙100 = 1∙100 =3,37 %.
Г(Ф) = nГ∙100 = 1∙100 =3,37 %.
nГ + nО2 + nN2 + nФ 1 +2,5 +9,4 + 16,79
Ответ:  Г(Ф) = 3,37 %.
Г(Ф) = 3,37 %.
Задача 6
Начертить зависимость КПР 2-метил-2-бутанол от концентрации флегматизатора.
Решение.
Для того чтобы начертить зависимость КПР от концентрации флегматизатора, необходимо рассчитать минимальную флегматизирующую концентрацию (МФК) и концентрационные пределы распространения (КПР).
1. Рассчитаем МФК:
 МФК = nФ∙100 = 16,79∙100 = 56,55%.
МФК = nФ∙100 = 16,79∙100 = 56,55%.
nГ + nО2 + nN2 + nФ 1 + 2,5 + 9,4+ 16,79
2. Рассчитаем концентрацию горючего в точке флегматизации:
 Г(Ф) = nГ∙100 = 1∙100 =3,37 %.
Г(Ф) = nГ∙100 = 1∙100 =3,37 %.
nГ + nО2 + nN2 + nФ 1 +2,5 +9,4 + 16,79
3. Рассчитаем КПР:
 Н = 100 = 100 = 3,79 %;
Н = 100 = 100 = 3,79 %;
an+ b 8,684∙2,5+4,679
 В = 100 = 100 = 22,54 %;
В = 100 = 100 = 22,54 %;
an+ b 1,550∙2,5+0,560
Задача 7
Рассчитать минимальное взрывоопасное содержание кислорода (МВСК) 2-метил-2-бутанол.
Решение.
1. Запишем химическое уравнение горения 2-метил-2-бутанол
С5Н12O +2,5 (О2 + 3,76N2) = 5CO +6H2O + 2,5∙3,76N2,
2. Рассчитаем МВСК:
 МВСК = nО2∙100 = 2,5∙100 = 8,4 %.
МВСК = nО2∙100 = 2,5∙100 = 8,4 %.
nГ + nО2 + nN2 + nФ 1 +2,5 +9,4 +16,79
Ответ:  МВСК = 8,4%.
МВСК = 8,4%.
Задача 8
Определить значения температурных пределов распространения пламени 2-метил-2-бутанол.
Решение.
1. Рассчитаем нижний и верний концентрационные пределы распространения пламени (НКПР) 2-метил-2-бутанол:
 Н = 100 = 100 = 3,79 %;
Н = 100 = 100 = 3,79 %;
an+b 8,684∙2,5+4,679
 В = 100 = 100 = 22,54 %;
В = 100 = 100 = 22,54 %;
an+b 1,550∙2,5+0,560
2. Определим, какому давлению насыщенного пара соответствует значение нижнего концентрационного предела:
РН =  Н Р0
Н Р0
РН = 3,79 ∙ 101,3 = 3,84 кПа.
3. Воспользуемся уравнением Антуана, чтобы найти значение НТПР:
lgP = A - B;
C + t
Решим уравнение Антуана относительно t:
t = B - С;
А + lgP
tН = 1252,216 - 180,301 = - 2,10С = 270,9К.
6,44711+0,58
Рв = 22,54∙ 101,3 = 22,8 кПа.
tв = 1252,216 - 180,301 = - 19,90С = 53,9К.
6,44711+1,36
Ответ: tН = 270,9 К. tв= 53,9К.
Задача 9
Вычислить температуру самовоспламенения 2-метил-2-бутанол.
Решение.
1. Запишем структурную формулу соединения, нумеруем все атомы углерода:
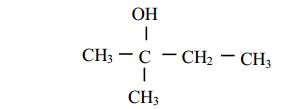
2. В молекуле соединения 3 концевых метильных групп СН3 и одна OH группа, т.е. МР = 4. Определим число цепей:
m = MP(MP – 1) = 4(4 – 1) =6.
2 2
3. Найдем эти цепи и установим их длину. Составим таблицу
| Углеродная цепь, mi | 1-6 | 1-4 | 1-5 | 6-4 | 6-5 | 5-4 |
| Длина цепи, li |
4. Определим средне арифметическое значение длины углеродных цепей
lСР = 3 ∙4 + 3∙3 = 3,5
5. С помощью табл. VII приложения находим температуру самовоспламенения 2-метил-2-бутанол по значению средней длины цепи в молекуле соединения и рассчитаем температуру самовоспламенения:
ТСВ = 300-38∙√(lср - 5)=717 К = 444оС
Ответ: ТСВ = 444оС
Задача 10
Рассчитать максимальное давление взрыва 2-метил-2-бутанол. Считать, что исходная смесь до взрыва находилась при нормальных условиях (T0 = 273 K, P0 = 101,3 кПа). Оценить возможность разрушения технологического оборудования, рассчитанного на давление Рпред = 1,5∙103 кПа при взрыве 2-метил-2-бутаноловой смеси.
Решение.
Запишем уравнение материального баланса процесса горения 2-метил-2-бутанол в воздухе
С5Н12O +7,5 (О2 + 3,76N2) = 5CO2 +6H2O + 7,5∙3,76N2,
По уравнению определим количество молей газовой смеси до взрыва nc и после взрыва nпг
nc = nг + nО2 + nN2 = 1 + 7,5 + 7,5∙3,76 = 36,7 моль;
nпг = nСО2 + nН2О + nN2 = 5 + 6 + 7,5∙3,76 = 39,2 моль;
Рассчитаем максимальное давление взрыва:
Рmaxвзр = Р0 Твзрnпг = 101,3∙ 2301,26∙39,2 = 912,08кПа.
Т0 nc 273∙36,7
Избыточное давление взрыва
Рвзр = Рmaxвзр – Р0 = 912,08– 101,3 = 810,77кПа,
так как Рmaxвзр < Рпред, можно сделать вывод, что технологическое оборудование не разрушится.
Ответ: Рmaxвзр= 810,77 кПа.
Задача 11
Рассчитать тротиловый эквивалент вещества 2-метил-2-бутанол.
Решение.
1. Для определения тротилового эквивалента вещества hТНТ паровоздушного облака необходимо рассчитать низшую теплоту сгорания QH:
Низшую теплоту сгорания 2-метил-2-бутанол рассчитаем по закону Гесса, взяв значение теплоты образования веществ из табл. II приложения.
QH = 5ΔH0CO2 + 6ΔH0H2O - ΔH0C5H12О = 5∙316.6 + 6∙242.2 – 330 =2706,2 кДж/моль.
Q`H = QН = 2706,2 =30,75 ∙ 103
M 88∙10-3
Доля потенциальной энергии, перешедшей в кинетическую энергию при взрыве облака парогазовой смеси принимается равной 0,4. Энергия взрыва тротила QТНТ = 4,19 ∙ 102 кДж/кг.
2. Рассчитаем тротиловый эквивалент вещества 2-метил-2-бутанол:
hТНТ = Q`Н;
QТНТ
hТНТ = 30,75 ∙ 10 3 = 7,34
4,19 ∙ 103
Ответ: hТНТ = 7,34
Часть 2. Сравнение полученных расчетных значений со справочными данными.
Расчетные значения параметров горения и взрыва 2-метил-2-бутанол:
| Параметр горения и взрыва | Адиабат. т-а гор., ТАД | Тем-ра взрыва, ТВЗР | КПР | МФК (Н2О) | МВСК | ТПР | Тем-ра самовоспл., ТСВ | Макс. давление взрыва, PMAX | Тротил. эквивалент вещ-ва, hТНТ |
| Значение параметра | 1847,15 | 2301,26 | Н = 1,43%; В = 8,12%; | МФК = 56,55%. | МВСК = 8,4%. | tН = 270,9К; tВ = 53,9К. | ТСВ = 444оС; | Рmaxвзр= 810,77кПа. | hТНТ = 7,34 |
Показатели пожарной опасности 2-метил-2-бутанол из справочной литературы:
| Параметр горения и взрыва | Адиабат. т-а гор., ТАД | Тем-ра взрыва, ТВЗР | КПР | МФК (Н2О) | МВСК | ТПР | Тем-ра самовоспл., ТСВ | Макс. давление взрыва, PMAX | Тротил. эквивалент вещ-ва, hТНТ |
| Значение параметра | 2200,2 | Н = 1,25%; В = 7,45%; | МФК = 33,68% %. | МВСК = 16,84%. | tН = 327К; tВ = 363 К. | ТСВ = 300оС; | - | - |
Рассчитаем погрешности параметров горения и взрыва:
ТАД = 2200,2 – 2140,35 ∙ 100 = 2,7%;
2200,2
ТВЗР = 2612 – 2574,26 ∙ 100 = 1,75%;
КПР:  Н = 1,25 – 1,2 ∙ 100 = 4%;
Н = 1,25 – 1,2 ∙ 100 = 4%;
1,25
 НВ = 7,45 – 7,4 ∙ 100 = 0,67%;
НВ = 7,45 – 7,4 ∙ 100 = 0,67%;
7,45
МФК (Н2О) = 33,68 – 32,25 ∙ 100 = 4,25%;
33,68
МВСК = 16,84 – 16,49 ∙ 100 = 2,08%;
16,84
ТСВ = 300 – 219 ∙ 100 = 27%.
 2018-01-08
2018-01-08 1566
1566