Скоростью химической реакции называется изменение концентраций реагирующих или образующихся веществ в единицу времени.

Гомогенная реакция – система которая протекает в системе состоящей из одной фазы. Скорость такой реакции – изменение кол-ва реагирующего или образующегося вещ-ва в единицу времени в единице объема системы.

Гетерогенная реакция протекает на границе фаз в системе, состоящей из нескольких фаз. Скоростью такой реакцией наз. изменение кол-ва реагирующего или образующегося вещ-ва в единицу времени на единице площади раздела фаз.
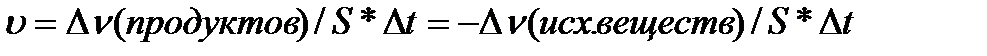
Скорость реакции зависит от природы реагирующих веществ, а ток же от концентрации, температуры, наличия катализатора.
Закон действующих масс – скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях их стехиометрических коэффициентов.
mA+nB=pAB  где Са и Сb – молярные концентрации, k – константа скорости.
где Са и Сb – молярные концентрации, k – константа скорости.
Правило Ван-Гоффа. С повышением температуры на 10С скорость реакций возрастает в 2-4 раза.

Правило Вант-Гоффа
По этому правилу, при увеличении температуры на 10 градусов, скорость химической реакции возрастает в 2-4 раза. Температурный коэффициент: 

V –объем системы не меняется, тогда 


При увеличении температуры, резко возрастает число активных молекул, которые обладают избыточной энергией  скорость реакции увеличивается.
скорость реакции увеличивается.
Согласно …….. уравнению ……… константа скорости записывается:



Уравнение Аррениуса:

где к – константа скорости реакции;  – предэкспонециальный множитель; е – основание натурального логарифма; Еа – постоянная, называемая энергией активации, определяемая природой реакции. Уравнение Аррениуса позволяет проводить более точные расчеты изменения скорости реакции с увеличением температуры, чем уравнение Вант-Гоффа.
– предэкспонециальный множитель; е – основание натурального логарифма; Еа – постоянная, называемая энергией активации, определяемая природой реакции. Уравнение Аррениуса позволяет проводить более точные расчеты изменения скорости реакции с увеличением температуры, чем уравнение Вант-Гоффа.
 2018-01-21
2018-01-21 793
793








