Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
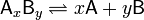
Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта разделяться обратимым образом на маленькие объекты, например, когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации. Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
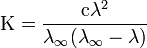
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении.
 2018-01-21
2018-01-21 637
637








