Венозную кровь.
Основные электролиты в организме человека: натрий (Na+), калий (K+) и хлор (Cl-).
Большая часть натрия содержится в межклеточных жидкостях. Калий находится главным образом внутри клеток, однако небольшое, но жизненно важное его количество есть в плазме, жидкой части крови.
Контроль за уровнем калия очень важен. Даже его незначительные изменения могут повлиять на сердечный ритм и на способность сердца к сокращениям. Хлориды мигрируют через мембрану то внутрь, то наружу клетки и тем самым поддерживают её электронейтральность. Уровень хлоридов обычно соответствует уровню натрия.
Натрий, калий и хлориды поступают в организм вместе с едой, тогда как почки участвуют в выводе их из организма. Баланс этих химических элементов является важным показателем здоровья человека, в частности того, как функционируют почки и сердце.
Совместное измерение уровней натрия, калия и хлоридов позволяет определить анионовое «окно» – разницу в содержании анионов и катионов в крови. Его аномальная величина не является специфичным показателем, однако предполагает присутствие в организме токсических веществ (оксалатов, гликолатов, аспирина) или вероятность метаболических отклонений, вызванных голоданием или сахарным диабетом.
Поскольку электролитный и кислотно-щелочной дисбалансы сопутствуют широкому спектру острых и хронических заболеваний, анализ на электролиты может быть назначен как уже госпитализированным пациентам, так и только что обратившимся в отделения экстренной медицинской помощи.
25. Ионное произведение воды. Водородный показатель.
При определенных условиях, вода может вести себя как акцептор протонов (в присутствии кислоты) или как донор протонов (в присутствии основания). Интересной особенностью воды является то, что она может подвергаться процессу самодиссоциации (автоионизации), т.е. быть одновременно донором и акцептором протонов по отношению к самой себе.
2H2O ↔ H3O+ + OH—
Эта реакция – самопроизвольная диссоциация, осуществляется в небольшой степени. Ее можно упростить, если H3O+ заменить на H+
H2O ↔ H+ + OH—
Запишем выражение для константы равновесия, опираясь на закон действия масс:
K = [H+]·[OH—]/[H2O]
Концентрацию воды, принято исключать из данного выражения, вследствие ее практически постоянного значения в разбавленных растворах. Получаем новую константу равновесия KН2О, которая называется ионным произведением воды:
KН2О = [H+]·[OH—]
При температуре 25ºС KН2О = 1·10^-14 и остается постоянным в водных растворах кислот, щелочей, солей или других соединений.
KН2О = [H+]·[OH—] = 1·10^-14
При повышении температуры ионное произведение воды сильно возрастает.
Полученное выражение применимо не только к чистой воде, но и к растворам.
Если осуществляется условие [H+] = [OH—], то раствор называется нейтральным, но обычно эти величины не совпадают, тогда при увеличении одного показателя, другой должен уменьшаться, так, чтобы их произведение оставалось постоянным (1·10^-14)
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ PH
Водородный показатель – это величина, численно равная отрицательному десятичному логарифму концентрации водородных ионов, выраженной в грамм-ионах на литр.
Увеличение или уменьшение концентраций иона водорода или гидроксид — иона меняет характер среды. Таким образом, в растворах с различным характером среды, при температуре 25ºС, выполняются следующие условия:
Нейтральная среда [H+] = [OH—] = 10-7 М
Кислая среда [H+] > [OH—], [H+] > 10-7 М, [OH—] ˂ 10-7 М
Щелочная среда [H+] ˂ [OH—], [H+] ˂ 10-7 М, [OH—] > 10-7 М
Следует помнить, что не зависимо от характера среды, в водных растворах всегда существуют оба иона.
pH и pOH нейтрального раствора равен 7:
Нейтральная среда pH = pOH = 7, pH + pOH = 14
Кислая среда pH ˂ pOH, pH ˂ 7, pH + pOH = 14
Щелочная среда pH>pOH, pH> 7, pH + pOH = 14
На следующем рисунке наглядно показано зависимость характера среды от величины pH
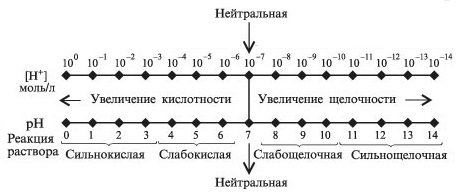
26. Активная, общая и потенциальная кислотность и основность растворов.
В растворе любой слабой кислоты различают общую, активную и потенциальную кислотности:
1.общая кислотность соответствует общей концентрации кислоты. Иначе ее называют титруемой или аналитической и определяют титрованием.
2.активная кислотность равна концентрации (точнее активности) свободных ионов Н+ в растворе.
3.потенциальная кислотность представляет собой «запас» недиссоциированных молекул кислоты и может быть вычислена вычитанием из общей кислотности активной.
В качестве примера можно привести уксусную кислоту:
По аналогии с раствором слабых кислот в растворах слабых оснований можно различать общую, активную и потенциальную щелочность.
Для сильных кислот и щелочей, у которых степень диссоциации равна единице, активная реакция будет соответствовать общей концентрации кислоты или щелочи.
27. Методы определения рн, кислотности и щелочности. Кислотно-основные индикаторы.
Методы для определения рН довольно разнообразны. Определение кислотности или щелочности среды можно произвести с помощью таких методов как использование индикаторов, измерение pH-метром или проведение кислотно-основного титрования.
Электрометрическое определение ph растворов
Определение ph раствора этим методом сводится к установлению потенциала электрода определения, погруженного в исследуемый раствор, и основано на зависимости величины потенциала е(х) от ph.
Метод определения рН с помощью pH-метра дает возможность измерить кислотность более точно и в достаточно широком диапазоне. Подобный метод определения кислотности основан на измерении прибором ЭДС гальванической цепи, состоящей из стеклянного электрода, потенциал которого зависит от концентрации положительно заряженных ионов водорода в исследуемом растворе.
Индикаторы кислотно-основные — органические вещества, изменяющие характер окраски (двухцветные индикаторы) или ее интенсивность (одноцветные индикаторы) при перемене рН среды.
Примерами двухцветных индикаторов могут служить лакмус — синий в щелочной среде и красный в кислой; метиловый оранжевый — желтый в щелочной и розовый в кислой среде; к одноцветным индикаторам относится фенолфталеин — бесцветный в кислой среде и малиновый в щелочной.
Индикаторы являются слабыми органическими кислотами или слабыми органическими основаниями, окраска недиссоциированных молекул которых отличается от окраски образуемых ими органических ионов. Так, недиссоциированные молекулы слабой кислоты — фенолфталеина — бесцветны, а образуемые ею анионы малинового цвета. При изменении рН среды меняется соотношение между числом недиссоциированных молекул и ионов, вследствие чего изменяется окраска индикатора. Перемена окраски индикатора происходит в свойственном каждому индикатору узком интервале значений рН среды (зона перемены окраски индикатора).
Индикаторы применяются: для определения конца титрования при определении кислотности желудочного сока, а также содержания кислот и щелочей в различных растворах; для колориметрического определения рН биологических жидкостей; для качественного определения кислотности или щелочности среды. Для всех этих целей индикаторы применяют в виде водных или спиртовых растворов или в виде специальных индикаторных бумажек (полоски фильтровальной бумаги, пропитанные растворами индикаторов).
28. Кислотно-основное титрование. Кривое титрование.
Кислотно-основное титрование основано на реакции взаимодействия кислоты и основания, а точнее, ионов Н+ и гидроксильной группы ОН-
Н+ + ОН- ↔ Н2О.
В качестве титрантов используют сильные кислоты и основания. Если титрантом является кислота, метод называют ацидиметрия, если основание – алкалиметрия. В водной среде чаще всего титрантом служит соляная кислота HCl и гидроксид натрия NaOH, в неводных средах – хлорная кислота HClO4 и гидроксид тетрабутиламмония (C4H9)4NOH.
Прямым кислотно-основным титрованием определяют концентрацию кислот или оснований или содержание элементов, входящих в их состав. Обратным титрованием или косвенными методами находят содержание некоторых солей, например, солей аммония или кальция. Применяя специальные приемы, титруют смеси кислот с их солями, смеси солей и др.
В качестве индикаторов используют окрашенные слабые кислоты или основания. Изменение окраски индикатора наступает при определенном значении рН раствора.
| Титрование | Точка эквивалентности | Индикатор |
| сильного основания сильной кислотой или наоборот | в нейтральной среде | фенолфталеин или любой другой индикатор |
| слабого основания сильной кислотой | в кислой среде | метилоранж |
| слабой кислоты сильным основанием | в щелочной среде | фенолфталеин |
На правильность работы индикатора влияет также его концентрация, температура, наличие примесей в анализируемой пробе.
Кривые титрования
Важной характеристикой титриметрических методов являются кривые титрования. Они показывают графическую зависимость концентрации участника реакции, протекающей при титровании (либо логарифма концентрации или какой-то характеристики раствора) от объема добавленного титранта (либо от степени оттитрованности). Например, для реакций кислотно-основного взаимодействия такой характеристикой раствора служит его pH.
Различают рассчитанные теоретически и экспериментальные кривые титрования. Теоретический расчет кривых титрования обычно проводится по данным о константе равновесия реакции, протекающей при титровании, и исходным концентрациям реагирующих веществ. Если нормальные концентрации титруемого раствора и титранта одинаковы и для титрования взяли 100,0 мл раствора, то число миллилитров добавленного титранта будет равно степени протекания реакции между титрантом и определяемым веществом (степени оттитрованности). Такие кривые служат главным образом для обоснованного выбора индикатора в данном титровании, который обеспечил бы необходимую точность определения.
Экспериментальные кривые титрования получают, измеряя какое-либо свойство системы в ходе титрования (оптическую плотность, диффузионный ток и т.д.) в зависимости от объема добавленного титранта и строят соответствующий график. Такие кривые служат для определения точки эквивалентности.
28. Буферные системы и буферные растворы
Одним из характерных свойств внутренней среды организмов является постоянство концентрации водородных ионов (изогидрия). Так, например, pH крови человека 7,36. Сохранение этого показателя обеспечивается совместным действием ряда физико-химических и физиологических механизмов, из которых очень важная роль принадлежит буферным системам.
Буферные системы – растворы, обладающие свойством достаточно стойко сохранять постоянство концентрации водородных ионов как при добавлении кислот или щелочей, так и при разведении; смесь слабой кислоты с сопряженным основанием или слабого основания с сопряженной кислотой.
Значение pH буферных растворов можно рассчитать по формулам:
Для слабой кислоты HA и её соли с сильным основанием BA
pH = pK(на) - lg C(на)/С(ва)
Для слабого основания BOH и его соли с сильной кислотой HA
pH = pH – pK(вон) + lg С(вон)/С(на)
Например, pH аммиачного буферного раствора NH4OH + NH4Cl определяется формулой:
pH = pH – pK(NH4OH) + lg C(NH4OH)/C(NH4Cl)
pH карбонатного буферного раствора выражается формулой:
pH = pK2 - lg C(NaHCO3/C(Na2CO3)
 2018-01-21
2018-01-21 777
777








