В организме образуются большие количества кислых продуктов. Например, у человека ежесуточно образуются 2-3 л 0,1 н. соляной кислоты. Сохранение постоянства реакции среды организма обеспечивается наличием в них мощных буферных систем. В человеческом организме особенно большую роль играет белковый, гемоглобиновый, бикарбонатный и фосфатный буфера. В крови решающую роль играет наиболее мобильный гидрокарбонатный буфер, а в тканях – фосфатный. Гемоглобиновый, окси-гемоглобиновый и белковый буфера хотя и имеют большую емкость, но она мало способна к изменениям вследствие относительного постоянства концентрации гемоглобина, белков. В то же время концентрация компонентов бикарбонатного и фосфатного буферов легко может изменяется и именно за счет этих буферов организм регулирует рН.
Ацидоз и алкалоз. Когда компенсаторные механизмы организма не способны предотвратить сдвиги концентрации водородных ионов, наступает нарушение кислотно-оснóвного равновесия. При этом наблюдаются два противоположных состояния – ацидоз и алкалоз. При ацидозе концентрация водородных ионов в крови становится выше границ нормы. При этом, естественно рН уменьшается. Снижение величины рН ниже 6,8 вызывает смерть. Состояние алкалоза наблюдается при уменьшении концентрации ионов Н+ (рН, соответственно, возрастает) по сравнению с нормой. Увеличение значений рН до 8,0 приводит к быстрому летальному исходу.
Щелочной резерв крови – это количество бикарбоната (NaHC03) (точнее объем С02, который может быть связан плазмой крови). Этувеличину лишь условно можно рассматривать как показатель кислотно-щелочного равновесия, так как, несмотря на повышенное или пониженное содержание бикарбоната, при наличии соответствующих изменений Н2СО3 рН может оставаться совершенно нормальным.
32.Буферные системы крови. Буферные системы в организме функционируют в тесной взаимосвязи друг с другом. Транспорт углекислого газа и кислорода в тканях и легких возможен только при взаимодействии гемоглобинового, оксигемоглобинового и бикарбонатного буферов. Известно, венозная кровь содержит большое количество углекислоты в виде бикарбонатов и комплексов с гемоглобином. Через легкие углекислота выделяется в воздух, однако сдвига рН в щелочную сторону не происходит, т.к. образующийся оксигемоглобин является более сильной кислотой, чем гемоглобин. В тканях, в артериальной крови под влиянием низкого парциального давления кислорода оксигемоглобин диссоциирует и кислород диффундирует в ткани. Образующийся при этом гемоглобин не сдвигает рН крови в щелочную сторону, т.к. в кровь из тканей поступает углекислота.
Таблица “Относительная емкость отдельных буферных систем в цельной крови"
| Буферные системы | Доля, в % |
| 1. Гемоглобиновая и оксигемоглобиновая | 3* |
| 2. Органическая фосфатная | |
| *. Неорганическая фосфатная | |
| 4. Белковая плазмы крови | |
| 5. Бикарбонатная | |
| v бикарбонатная плазмы | |
| v бикарбонатная эритроцитов |
33.Теории кислот и оснований — совокупность фундаментальных физико-химических представлений, описывающих природу и свойства кислот и оснований. Все они вводят определения кислот и оснований — двух классов веществ, реагирующих между собой. Задача теории — предсказание продуктов реакции между кислотой и основанием и возможности её протекания, для чего используются количественные характеристики силы кислоты и основания. Различия между теориями лежат в определениях кислот и оснований, характеристики их силы и, как следствие — в правилах предсказания продуктов реакции между ними. Все они имеют свою область применимости, каковые области частично пересекаются.
Теория Аррениуса, выдвинутая им в 1887 году, объясняла появление ионов в водном растворе (или расплаве) распадом растворенных веществ - электролитов. Этот процесс распада был назван электролитической диссоциацией. Аррениус из всех ионов выделил ионы H+ и OH- как продукты автодиссоциации воды: H2O  H+ + OH-
H+ + OH-
Затем он высказал утверждение, что все кислоты образуют в растворе катионы водорода (H+), а все основания - гидроксид-ионы (OH-):
Кислоты: HNO3  H+ + NO3- и HNO2
H+ + NO3- и HNO2  H+ + NO2-
H+ + NO2-
Основания: NaOH  Na+ + OH- и NH3 . H2O
Na+ + OH- и NH3 . H2O  NH4+ + OH-
NH4+ + OH-
Кислоты и основания, для которых степень распада на ионы (степень электролитической диссоциации) имеет значение, близкое к единице, были названы Аррениусом сильными (HNO3, NaOH), а все остальные - слабыми (HNO2, NH3. H2O).
34.Протонная теория кислот и оснований Бренстеда. В 1923 г. Бренстед и Лоури выдвинули новую теорию кислот и оснований, основанную на представлении о переносе протона. Согласно этой теории, кислота - это вещество, способное отдавать протон другому веществу, т.е. кислота - это донор протонов. Противоположные свойства имеют основания, которые могут принимать протоны, и являются, следовательно, акцепторами протонов. Эти определения приводят к правильному заключению, что все реакции типа кислота-основание состоят в переносе протона от молекулы кислоты к молекуле основания. Реакции отщепления и присоединения протона обратимы; молекула (или ион), образованная в результате отщепления протона от кислоты, может присоединить протон обратно. Таким образом, в обратимой реакции отщепления протона от донора - кислоты - возникает акцептор - основание.
35. Строение молекул, общие параметры молекул. При взаимодействии атомов между ними может возникать химическая связь, приводящая к образованию устойчивой многоатомной системы - молекулы, молекулярного иона, кристалла. Теория химического строения (1861) Бутлеров:
1) Атомы в молекулах соединены друг с другом в определенной последовательности.
2) Соединение атомов происходит в соответствии с их валентностью.
3) Свойства веществ зависят не только от их состава, но и от их химического строения.
Полярные и неполярные растворители. Полярные растворители – это химические соединения, молекула которых является диполем. Все полярные представители в своей молекуле имеют донорные атомы, но при этом подразделяются на содержащие подвижные протоны или протонные (воду, карбоновые кислоты, амины), а также не содержащие такие протоны, другое название апротонные (кетоны, простые эфиры, а также третичные амины).
К достоинствам полярных растворителей можно отнести:
- способность к образованию водородных связей;
- содержание кислого протона;
- способность к стабилизации ионов: катионов – за счет неподеленной пары электронов; анионов – за счет полученных водородных связей.
- высокая диэлектрическая проницаемость;
- способность растворять различные полярные органические вещества;
- широкие температурные пределы жидкого состояния.
Неполярные вещества – это соединения, молекула которых диполем не является. Они не растворяют соли и основания, часто в реакциях выступающих нуклеотидными реагентами. Поэтому в таких случаях данные растворители применяются редко. Также они имеют низкую температуру кипения, что не позволяет их использовать в реакциях с термическим возбуждением молекул.
Неполярные смеси великолепно растворяют неполярные молекулы газов. Это свойство достаточно широко используется для получения сжатых газов, структура которых крайне неустойчива и опасна, но в растворенном состоянии они прекрасно транспортируются и хранятся в стальных баллонах. Наиболее известные растворители данного класса – это ацетон, Уайт-спирит, бензол.
36. Ковалентная связь. Метод валентных связей. Исследование Гейтлера и Лондона(1927) говорит, что химическая связь в молекуле водорода осуществляется путем образования пары электронов с противоположно направленными спинами, принадлежащей обоим атомам. Процесс спаривания электронов при образовании молекул:
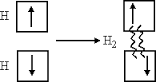
Волнистые линии на схеме показывают, что в молекуле водорода каждый электрон занимает место в квантовых ячейках обоих атомов, т. е. движется в силовом поле, образованном двумя силовыми центрами — ядрами атомов водорода.
Такая двухэлектронная двухцентровая связь называется ковалентной связью.
Представления о механизме образования химической связи, развитые Гейтлером и Лондоном на примере молекулы водорода, были распространены и на более сложные молекулы. Разработанная на этой основе теория химической связи получила название метода валентных связей (метод ВС).
В основе метода ВС лежат следующие положения:
1. Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. Комбинации таких двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем.
2. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
37. Полярная и неполярная ковалентная связь. Если двухатомная молекула состоит из атомов одного элемента, как, например, молекулы Н2, N2, СЬ и т. п., то каждое электронное облако, образованное общей парой электронов и осуществляющее ковалентную связь, распределяется в пространстве симметрично относительно ядер обоих атомов, ковалентная связь называется неполярной или г о м е о п о л я р н о й. Если же двухатомная молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов, так что возникает асимметрия в распределении заряда. В таких случаях ковалентная связь называется полярной или г е т е р о п о л я р н о й.
Гибридизация орбиталей. Метод гибридизации атомных орбиталей исходит из предположения, что при образовании молекулы вместо исходных атомных S-, р- и d-электронных облаков образуются такие равноценные «смешанные» или гибридные электронные облака, которые вытянуты по направлению к соседним атомам, благодаря чему достигается их более полное перекрывание с электронными облаками этих атомов. Такая деформация электронных облаков требует затраты энергии. Но более полное перекрывание валентных электронных облаков приводит к образованию более прочной химической связи и, следовательно, к дополнительному выигрышу энергии. Если этот выигрыш энергии достаточен, чтобы с избытком скомпенсировать затраты энергии на деформацию исходных атомных электронных облаков, такая гибридизация приводит, в конечном счёте, к уменьшению потенциальной энергии образующейся молекулы и, следовательно, к повышению ее устойчивости. Случай гибридизации одной s- и одной р-орбитали, приводящий к образованию двух sp-орбиталей, называется sp-гибрадизацией.
38. Виды химической связи. Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения.
| Химическая связь | Связываемые атомы | Характер элементов | Процесс в электронной оболочке | Образующиеся частицы | Кристаллическая решетка | Характер вещества | Примеры |
| Ионная | Атом металла и атом неметалла | Электроположительный и электро отрицательный | Переход валентных электронов | Положительные и отрицательные ионы | Ионная | Солеобразный | NaCl CaO NaOH |
| Ковалентная | Атомы неметаллов (реже-атомы металлов) | Электроотрицательный реже электроположительный | Образование общих электронных пар, заполнение молекулярных орбиталей | Молекулы | Молекулярная | Летучий или нелетучий | Br2 CO2C6H6 |
| --------- | Атомная | Алмазоподобный | Алмаз Si SiC | ||||
| Металлическая | Атомы металлов | Электроположительный | Отдача валентных электронов | Положительные ионы и электронный газ | Металлическая | Металлическая | Металлы и сплавы |
Ионная связь. Связь такого типа осуществляется в результате взаимного электростатического притяжения противоположно заряженных ионов. Ионы могут быть простыми, т. е. состоящими из одного атома (например, катионы Na+, К+, анионы F~, С1~), пли сложными, т. е. состоящими из двух или более атомов, (например, катион NH*, анионы ОН", N0^", SO*"). Простые ионы, обладающие положительным зарядом, легче всего образуются из атомов элементов с низким потенциалом ионизации; к таким элементам относятся металлы главных подгрупп I и II группы. Образование простых отрицательно заряженных ионов, напротив, характерно для атомов типичных неметаллов, обладающих большим сродством к электрону. Поэтому к типичным соединениям с ионным типом связи относятся галогениды щелочных металлов, например, NaCl, CsF и т. п. В отличие от ковалентной связи, ионная связь не обладает направленностью. Это объясняется тем, что электрическое поле иона обладает сферической симметрией, т. е. убывает с расстоянием по одному и тому же закону в любом направлении. Ионная связь не обладает насыщаемостью. Поэтому к данному иону может присоединиться различное число ионов противоположного знака.
39. Водородная связь. Роль водородной связи в пространственной организации органических соединений. Способность атома водорода, соединенного с атомом сильно электроотрицательного элемента, к образованию еще одной химической связи с другим подобным атомом. Эта связь называется водородной. Возникновение водородной связи можно в первом приближении объяснить действием электростатических сил. Условием образования водородной связи является высокая электроотрнцательность атома, непосредственно связанного в молекуле с атомом водорода. Только при этом условии электронное облако атома водорода достаточно сильно смещается в сторону атома-партнера, а последний приобретает высокий эффективный отрицательный заряд. Именно поэтому водородная связь характерна для соединения самых электроотрицательных элементов: сильнее всего она проявляется у соединений фтора и кислорода, слабее — у соединений азота и еще слабее — у соединений хлора и серы. Водородная связь служит причиной некоторых важных особенностей воды — вещества, играющего огромную роль в процессах, протекающих в живой и неживой природе. Она в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты.
 2018-01-21
2018-01-21 1074
1074
