В образовании комплексных соединений важную роль играют донорно-акцепторные взаимодействия лиганда и центрального атома. Донором электронной пары, как правило, является лиганд. Акцептором - центральный атом, который имеет свободные орбитали. Связь эта прочна и не разрывается при растворении комплекса (неио-ногенна), и ее называют координационной.
Наряду с о-связями образуются π-связи по донорно-акцепторному механизму. При этом донором служит ион металла, отдающий свои спаренные d-электроны лиганду, имеющему энергетически выгодные вакантные орбитали. Такие связи называют дативными. Они образуются:
а) за счет перекрывания вакантных р-орбиталей металла с d-ор-биталью металла, на которой находятся электроны, не вступившие в σ-связь;
б) при перекрывании вакантных d-орбиталей лиганда с заполненными d-орбиталями металла.
Мерой ее прочности является степень перекрывания орбиталей лиганда и центрального атома. Направленность связей центрального атома определяет геометрию комплекса. Для объяснения направленности связей используются представления о гибридизации атомных орбиталей центрального атома. Гибридные орбитали центрального атома являются результатом смешения неравноценных атомных орбиталей, в результате форма и энергия орбиталей взаимно изменяются, и образуются орбитали новой одинаковой формы и энергии. Число гибридных орбиталей всегда равно числу исходных. Гибридные облака располагаются в атоме на максимальном удалении друг от друга Пространственная структура комплекса определяется типом гибридизации валентных орбиталей и числом неподеленных электронных пар, содержащихся в его валентном энергетическом уровне.
|
|
|
Эффективность донорно-акцепторного взаимодействия лиганда и комплексообразователя, а следовательно, и прочность связи между ними (устойчивость комплекса) определяются их поляризуемостью, т.е. способностью трансформировать свои электронные оболочки под внешним воздействием. По этому признаку реагенты подразделяются на «жесткие», или малополяризуемые, и «мягкие» - легкополя-ризуемые. Полярность атома, молекулы или иона зависит от их размера и числа электронных слоев. Чем меньше радиус и электронов у частицы, тем она меньше поляризуется. Чем меньше радиус и меньше электронов у частицы, тем она хуже поляризуется.
Жесткие кислоты образуют с электроотрицательными атомами О, N, F лигандов (жестких оснований) прочные (жесткие) комплексы, а мягкие кислоты образуют с донорными атомами Р, S и I лигандов, имеющих низкую электроотрицательность и высокую поляризуемость, прочные (мягкие) комплексы.
|
|
|
Константа образования (устойчивости) комплексного соединения запишется следующим образом:
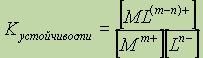 , где
, где
[Mm+] и [Ln-] концентации металла и лиганда соответственно, а [ML(m-n)+]- концентрация образующегося комплексного соединения. Константа образования – величина всегда положительная.
(При записи константы диссоциации в квадратные скобки берут равновесные концентрации ионов). Константа диссоциации характеризует термодинамическую устойчивость комплекса, зависящую от энергии связи между центральным атомом и лигандом. Различают также кинетическую устойчивость, или инертность, комплексной группировки — неспособность комплексного иона быстро обменивать внутрисферные ионы или молекулы на другие адденды. Например, [Fe (H2O)6]3+ и [Сr (H2O)6]3+ имеют почти одинаковые энергии связи Me — H2O (116 и 122 ккал/моль), но первый комплекс обменивает лиганды быстро, а второй (инертный) — медленно.
 2018-01-21
2018-01-21 589
589








