Водородные связи «вода – растворенное вещество» более слабые, чем «вода – ионное взаимодействие». Тем не менее, подобным образом связанная вода может быть классифицирована как «органически связанная» или «близлежащая», так как она менее подвижна по сравнению с основной водой в растворе.
Вещества, способные к образованию водородных связей, не должны разрушать нормальную структуру воды. Однако в ряде случаев отмечается ориентация водородных связей, отличная от нормальной воды. Вода может образовывать связь с различными потенциально подходящими группами (гидрокси-, амино-, карбонил-, амид- или имино-). Например, вода образовывать связи с двумя видами функциональных групп белков. Эти связи могут быть как в одной макромолекуле между различными группами, так и между разными макромолекулами.
В системе «вода – неполярное вещество» возможно два вида структурных образований за счет взаимодействия «вода – вещество».
1. Образование квадратных гидратов. Это соединения включения по типу «гость – хозяин». «Хозяином» в данном случае является сетка из 20-74 водных молекул, связанных друг с другом за счет водородных связей. «Молекулы-гости» в квадратных гидратах – это различные низкомолекулярные молекулы (углеводороды, галогенуглеводороды, спирты, амины, карбонильные соединения). Взаимодействие между водой и «гостем» часто происходит за счет слабых сил Ван-дер-Ваальса, в некоторых случаях может иметь и электростатический характер. Такого типа соединения могут образовываться в биологических материалах и влиять на биологическую активность таких молекул как белки, углеводы, липиды.
2. Гидрофобные взаимодействия в белках. Около 40% аминокислот в большинстве белков имеют неполярные группы. В гидрофобных взаимодействиях могут участвовать и неполярные группы в спиртах, жирных кислотах. По силе эти взаимодействия приблизительно такие же, как силы Ван-дер-Ваальса. Гидрофобные взаимодействия важны для четвертичной структуры многих белков, поэтому вода играет важную роль в стабилизации определенных конформаций белка.
Активность воды
Известно, что существует взаимосвязь между влагосодержанием пищевых продуктов и его сохранностью (или порчей). Поэтому основным методом удлинения сроков хранения пищевых продуктов всегда было уменьшение содержания влаги путем концентрирования или дегидратации. Однако часто различные пищевые продукты с одним и тем же содержанием влаги имеют различный срок хранения. Это зависит от того, насколько вода ассоциирована с неводными компонентами. Чем более связанной является вода, тем менее она способна поддерживать процессы порчи продукта, такие как рост микроорганизмов и гидролитические химические реакции.
Чтобы учесть эти факторы, был введен термин «активность воды». Этот термин более адекватно отражает влияние влаги на порчу продукта. Дополнительно следует учитывать pH, содержание кислорода, подвижность воды и многие другие факторы.
Активность воды обозначается a w. Это отношение давления паров воды над данным продуктом к давлению паров над чистой водой при одной и той же температуре. Это отношение входит в основную термодинамическую формулу определения энергии связи влаги с материалом (уравнение Ребиндера):
DF=RT ln  ,
,
где DF – уменьшение свободной энергии (при постоянной температуре);
R – универсальная газовая постоянная;
p0 – давление пара чистой воды;
pw – давление водяного пара в системе пищевого продукта.
aw = 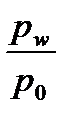 =
=  ,
,
где РОВ – относительная влажность в состоянии равновесия, при которой продукт не впитывается и не теряет влагу в атмосферу, %.
Таблица. Активность воды (aw) в пищевых продуктах
| Продукт | Влажность, % | aw |
| Фрукты | 90-95 | 0,97 |
| Яйца | 70-80 | 0,97 |
| Мясо | 60-70 | 0,97 |
| Сыр | 0,96 | |
| Джем | 30-35 | 0,82-0,94 |
| Хлеб | 40-50 | 0,95 |
| Кекс | 20-28 | 0,83 |
| Мука | 16-19 | 0,80 |
| Мед | 10-15 | 0,75 |
| Карамель | 7-8 | 0,65 |
| Печенье | 6-9 | 0,60 |
| Шоколад | 5-7 | 0,40 |
| Сахар | 0-0,15 | 0,10 |
Активность воды характеризует состояние воды в пищевых продуктах, ее причастность к химическим и биохимическим превращениям. По величине aw различают:
1. продукты с высокой влажностью (aw = 1,0-0,9);
2. продукты с промежуточной влажностью (aw = 0,9-0,6);
3. продукты с низкой влажностью (aw = 0,6-0,0).
Изотермы сорбции
Графические зависимости, характеризующие связь между содержанием влаги в г(H2O) / г(сухого вещества) в пищевом продукте с активностью воды в нем при постоянной температуре, называются изотермами сорбции. Информация, которую они дают, полезна с двух точек зрения:
1. для процессов концентрирования и дегидратации, т.к. простота или трудность удаления воды непосредственно связанна с aw;
2. для оценки стабильности пищевого продукта.
На ниже приведенном рисунке даны изотермы сорбции влаги для продуктов с высокой влажностью (рис.1) и для продуктов с низким содержанием влаги (рис.2).

рис.1
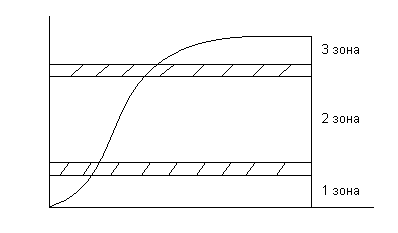
рис. 2
Свойства воды сильно отличаются по мере перехода от 1 зоны (сухая) к 2 зоне (высокая влажность). Вода, присутствующая в зоне 1 изотермы, наиболее сильно адсорбирована и наиболее неподвижна в пищевых продуктах. Эта вода абсорбирована, благодаря полярным вода-ион и вода-диполь взаимодействиям. Граница зон 1 и 2 (заштрихована) соответствует монослою содержания влаги в пище. Эта зона – чрезвычайно малая часть всей влаги в высоковлажном пищевом продукте.
Зона 2 – это вода, добавленная к пищевому продукту (ресорбция). Эта влага образует мультислой и взаимодействует с соседними молекулами через вода-вода-водородные связи. Она участвует в процессе растворения, действует как пластифицирующий агент, способствует набуханию твердой матрицы. Суммарная вода в зонах 1 и 2 составляет менее 5% от всей воды в высоковлажных продуктах.
В зоне 3 вода состоит из воды, которая была в зоне 1 и 2, и добавленной для образования зоны 3. Эта вода наименее связана и наиболее мобильна. Влага зоны 3 составляет более 95% от всей влаги пищевого продукта. Она может быть как свободной, так и удерживаемой в макромолекулярной матрице.
 2018-01-21
2018-01-21 897
897








