Внутренняя энергия, теплота и работа. При проведении хим.реакции изм-ся внутр.энергия системы U.Внутр.энергия вкл. В себя все виды энергии системы (энергию движения и взаимодействия молекул, атомов, ядер и других частиц, внутриядерную и другие виды энергии), кроме кинетической энергии движения системы, как целого, и потенциальной энергии ее положения. Как и любая характеристическая функция, внутренняя энергия зависит от состояния системы. Внутреннюю энергию нельзя измерить. Она представляет собой способность системы к совершению работы или передаче теплоты. Однако, можно определить ее изменение dU при переходе из одного состояния в другое:dU=U2-U1, где U2 и U1 — внутренняя энергия системы в конечном и начальном состояниях. Значение dU положительно (dU > 0), если внутренняя энергия системы возрастает.Изменение внутренней энергии можно измерить с помощью работы и теплоты, так как система может обмениваться с окружающей средой веществом или энергией в форме теплоты Q и работы W.Теплота Q представляет собой количественную меру хаотического движения частиц данной системы или тела. Энергия более нагретого тела в форме теплоты передается менее нагретому телу. При этом не происходит переноса вещества от одной системы к другой или от одного тела к другому.Работа W является количественной мерой направленного движения частиц, мерой энергии, передаваемой от одной системы к другой за счет перемещения вещества от одной системы к другой под действием тех или иных сил, например гравитационных.Теплота и работа измеряются в джоулях (Дж), килоджоулях (кДж) и мегаджоулях (МДж) и т.д. Положительной (W> 0) считается работа, совершаемая системой против действия внешних сил, и теплота (Q > 0), подводимая к системе. В отличие от внутренней энергии, работа и теплота зависят от способа проведения процесса, т.е. они являются функциями пути.
|
|
|
Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает первый закон термодинамики:Q = dU+W.
Выражение означает, что теплота, подведенная к системе, расходуется на приращение внутренней энергии системы и на работу системы над окружающей средой.
Первый закон термодинамики является формой выражения законa сохранения энергии. Согласно этому закону, энергия не может ни создаваться, ни исчезать, но может превращаться из одной формы в другую. Его справедливость доказана многовековым опытом человечества. Итак, любая система характеризуется внутренней энергией, мера-ми измерения которой служат теплота и работа. Приращение внутренней энергии системы в любом процессе равно сумме теплоты, подведенной к системе, и работы, которую совершают внешние силы над системой.
|
|
|
Вопрос 15.энтальпия. Термохимические законы Гесса. Энтальпия. Характеристическая функция U+pV=HНазывается энтальпией системы. Это одна из термодинамических функций, характеризующих систему, находящуюся при постоянном давлении. Qp = H2 —H1,= dH.Как видно из уравнения, в случае изобарического процесса(p=const), теплота, подведенная к системе, равна изменению энтальпии системы. Энтальпия зависит от кол-ва в-ва,поэтому ее изменение (dH),обычно относят к 1 моль и выражают в кДж\моль.Т.о.,изменение энергии системы при изобарических процессах,харак-ют через энтальпии этих процессов dH
Закон Гесса. В 1841 году российский ученый Г.И.Гесс открыл закон, получивший его имя. Тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции, т.е. от числа и характера промежуточных стадий. Закон Гесса лежит в основе термохимических расчетов. Однако рамки его действия ограничены изобарно-изотермическими и изохорно-изотермическими процессами. Проиллюстрируем закон Гесса на примере реакции сгорания метана:СН4 + 2О2 = СО2 + 2Н2О (г),dH = - 802,34 кДж.Эту же реакцию можно провести через стадию образованияСО:СН4 + 3/2О2 = СО + 2Н2О (г), dH°2 = - 519,33 кДж, СО + 1/2O2 = СО2,dH°з = - 283,01 кДж,dH=dH1 + dH°3 = (- 519,33) кДж + (- 283,01) кДж = - 802,34 кДж. тепловой эффект реакции, протекающей по двум путям, одинаков. Так как энтальпия зависит от со. стояния системы, но не зависит от пути процесса, то, если при проведении процесса система вернулась в исходное состояние, суммарное изменение энтропии системы равно нулю (dH = 0). Процессы, в которых система после последовательных превращений возвращается в исходное состояние, называются круговыми процессами или циклами. Метод циклов широко используется в термодинамических расчетах. Рассмотрим использование метода циклов на примере реакции взаимодействия метана с водяным паром. Исходная система:СН4 + 2 Н2О (г), р = const, Т = 298 К: Сh4 + 2Н2О (г) = СО + ЗН2 + Н2О (г), dH1;СО + Н2О (г) = СО2 + Н2, dH2; СО2 + 4Н2 = СН4 + 2Н2О (г), dH3.В результате этих трех реакций система вернулась в исходное со стояние, поэтому: Если известны любые два значения dH данного уравнения, можно определить третье. Например, известно dH°2 = -41,2 кДж/моль, dH°3 = -164,9 кДж/моль, тогда dH1=-dH°2 - dH°3 = + 41,2 + 164,9= = +206,1 кДж/моль. Итак, закон Гесса показывает, что каким бы путем не протекала реакция, ее тепловой эффект будет одинаков, если при этом не меняется конечное и исходное состояния системы. Энтальпия химических реакций. Закон Гесса позволяет рассчитать энтальпию химических реакций. Согласно следствию из закона Гесса, энтальпия химической реакции равна сумме энтальпии образования продуктов реакций за вычетом суммы энтальпий образования веществ исходных с учетом стехиометрических коэффициентов Стандартный тепловой эффект реакции получения водорода из природного газа:
СН4 + 2Н2О(г) = СО2 + 4Н2 определяется по уравнению:
∆H0298 =∆Hco2 298 +4∆HH2 - ∆HCH4 -2∆HH2O
Подставляя значения величин энтальпий образования из приложения 2 (в кДж/моль), получаем dH°298 = -1-393,51+4-0-1(-74,85)-2(241,82) = +164,98 кДж/моль. Как видно, данная реакция является эндотермической.
Вопрос 16 Энтропия химической реакции. Второй закон Мерой неупорядоченности состояния системы служит термодинамическая функция, получившая название энтропии.
Состояние системы можно характеризовать микросостояниями составляющих ее частиц, т.е. их мгновенными координатами и скоростями различных видов движения в различных направлениях. Число микросостояний системы называется термодинамической вероятностью системы W. Так как число частиц в системе огромно (например, в 1 моль имеется 6,02-1023 частиц), то термодинамическая вероятность системы выражается огромными числами. Поэтому пользуются логарифмом термодинамической вероятности In W. Величина, равная RlnW = S, называется энтропией системы. отнесенной к одному молю вещества. Как и молярная постоянная R, энтропия имеет единицу измерения Дж/(моль-К). Энтропия
|
|
|
вещества в стандартном состоянии называется стандартной энтропией S0. В справочниках обычно приводится стандартная энтропия S{0}<298> при 298,15 К
Второй закон термодинамики имеет несколько формулировок. Для систем, которые не обмениваются с окружающей средой ни энергией, ни веществом (изолированные системы), второй закон термодинамики имеет следующую формулировку: в изолированных системах самопроизвольно идут только такие процессы, которые сопровождаются возрастанием энтропии:. dS> 0. Второй закон термодинамики имеет статистический характер, т.е. справедлив лишь для систем, состоящих из очень большого числа частиц. Системы, в которых протекают химические реакции, не бывают изолированными, так как они сопровождаются изменением внутренней энергии системы (тепловым эффектом реакции), т.е. система обменивается энергией с окружающей средой. Химические реакции могут протекать самопроизвольно и без возрастания энтропии, но при этом увеличивается энтропия окружающей среды. Например, химические реакции в организме любого существа сопровождаются уменьшением энтропии (происходит упорядочение системы). Однако организм получает энергию из окружающей среды (пища, воздух). Получение пищевых продуктов сопровождается возрастанием энтропии окружающей среды, т.е. жизнь каждого существа связана с возрастанием энтропии. Однако, если в системе протекает химическая реакция, то система обменивается энергией с окружающей средой, т.е. не является изолированной. Химические реакции обычно сопровождаются изменением. Как энтропии, так и энтальпии.
Вопрос 17 Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность протекания химической реакции; этотермодинамический потенциал следующего вида:
|
|
|

Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
Определение
Классическим определением энергии Гиббса является выражение

где 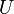 — внутренняя энергия,
— внутренняя энергия,  — давление,
— давление,  — объем,
— объем,  — абсолютная температура,
— абсолютная температура,  — энтропия.
— энтропия.
Вопрос 18 Скорость гомогенной реакции в целом определяется как скорость изменения глубины протекания реакции в единицу времени в единице объема:
| r = 1d ξi V dt |
Где V- объем системы; t – время. Определенная таким образом скорость реакции не зависит от выбора компонентов и будет практически одинаковой для разных веществ, участвующих в реакции.
Скорость реакции по i – компоненту
| r i = ± 1d n i V dt |
Она характеризует изменение количества i вещества n i (в молях) в единицу времени в единице объема.
Скорость реакции при постоянном объеме представляет собой изменение концентрации данного компонента в единицу времени. Скорость реакции есть положительная величина.
| r i = ± d С i уравнение также характеризует мгновенную скорость реакции dt |
Средняя скорость реакции в интервале времени от t1 до t2 определяется соотношением
| r ср = ± С2 - С1 = ± ΔС где С1 и С2 молярные концентрации любого участника реакции в момент t2 - t1 Δt времени t1 и t2 соответственно. |
На скорость гомогенной реакции могут оказывать влияние следующие факторы: природа реагирующих веществ; концентрации реагирующих веществ; давление (если в реакции участвуют газы); температура; наличие специфических веществ, ускоряющих реакцию (катализаторы) или замедляющих ее (ингибиторы); световое или радиационное излучение.
Основной постулат химической кинетики базируется на большом числе экспериментальных данных и выражает зависимость скорости реакции в каждый момент времени от концентрации реагирующих веществ: скорость реакции в каждый момент времени при постоянной температуре пропорциональна произведению концентраций реагирующих веществ, возведенных в некоторые степени. r = k СА n С В n
Коэффициент пропорциональности k называют константой скорости химической реакции. Константы скоростей значительно отличаются для разных реакций и сильно зависят от температуры.
Закон действия масс
Закон действия масс открыт опытным путем К.М. Гульдбергом и П. Вааге в 1867 г. Он гласит: При постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, причем каждая концентрации входит в произведение в степени, равной коэффициенту, стоящему перед формулой вещества в уравнении реакции.
Уравнение химической реакции в общем виде можно представить так:
аА + вВ ↔ сС + dD
Тогда скорость реакции можно выразить уравнением:
V = k*[A]a *[B]b
Все химические реакции можно разделить на обратимые и необратимые реакции. Необратимые реакции протекают до конца – до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают не до конца: ни одно из реагирующих веществ не расходуется полностью. Когда скорости прямой и обратной реакции становятся одинаковыми, наступает химическое равновесие. Количественной характеристикой химического равновесия служит константа химического равновесия.
Согласно закону действия масс, скорости прямой V1 и обратнойV2 реакции выражаются уравнениями:
V1= k1*[A]a *[B]b V2= k2*[C]c *[D]d
При равновесии V1 = V2, значит, k1*[A]a *[B]b= k2*[C]c *[D]d
Отношение констант скорости прямой и обратной реакций есть величина постоянная. Она и называется константой химического равновесия
К = k1 / k2 K = (k2*[C]c *[D]d)/k1*[A]a *[B]b
 2018-01-21
2018-01-21 1012
1012
