В о д о р о д н а я с в я з ь в ряду рассматриваемых соединений – это межмолекулярная связь между кислородом одной молекулы и гидроксильным водородом другой молекулы.
Справочная информация – электроотрицательность атомов: С – 2,5; Н – 2,1; О – 3,5.
Распределение электронной плотности в молекулах спиртов и карбоновых кислот неравномерное:
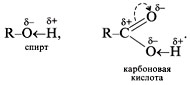
Водородную связь в спиртах и кислотах изображают так:
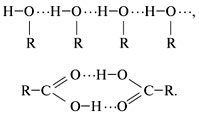
В ы в о д. В гомологических рядах спиртов и карбоновых кислот отсутствуют газообразные вещества и температуры кипения веществ высокие. Это связано с наличием водородных связей между молекулами. За счет водородных связей молекулы оказываются ассоциированными (как бы сшитыми), поэтому, чтобы молекулы стали свободными и приобрели летучесть, необходимо затратить дополнительную энергию на разрыв этих связей.
Многоатомные спирты
Предельные многоатомные спирты. Молекулы многоатомных спиртов содержат две и более гидроксильные группы.
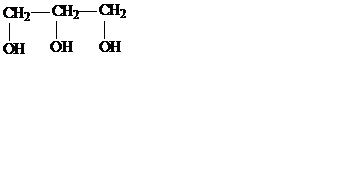
глицерин, или пропантриол–1,2,3
Физические свойства. Глицерин – вязкая, бесцветная, сладковатая на вкус нетоксичная жидкость с tкип = 290 0С.
Химические свойства. Для многоатомных спиртов характерны практически все реакции, в которые вступают одноатомные спирты.
Наличие нескольких ОН–групп в молекулах многоатомных спиртов обусловливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов(например, с гидроксидом меди (II) Сu(ОН)2). Продуктами этих реакций являются внутрикомплексные («хелатные») соединения, в молекулах которых атом тяжелого металла образует как обычные ковалентные связи Me–О за счет замещения атомов водорода ОН–групп, так и донорно-акцепторные связи Me ← О за счет неподеленных электронных пар атомов кислорода других ОН-групп.
Многоатомные спирты, как и одноатомные, взаимодействуют с органическими и неорганическими кислотамис образованием сложных эфиров:

Сложные эфиры глицерина и высших карбоновых кислот представляют собой жиры.
Получение глицерина.
1. Кислотный, щелочной или ферментативный гидролиз жиров:
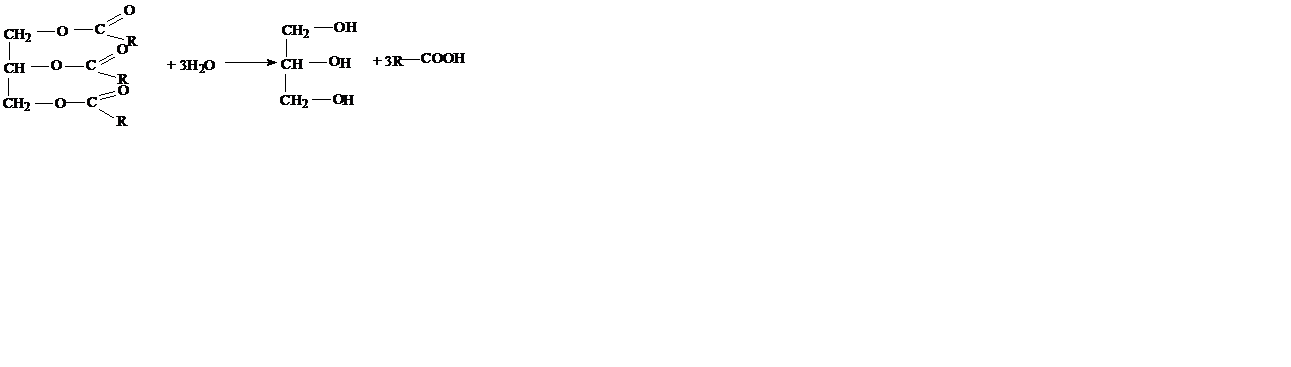
2. Синтез из пропилена.

пропилен аллилхлорид аллиловый спирт глицерин
Фенолы
Ароматические спирты (фенолы). Фенолы – это производные ароматических углеводородов, содержащие одну или несколько гидроксильных групп у атомов углерода бензольного кольца. Выделяют одноатомные фенолы, двухатомные (арендиолы) и трехатомные (арентриолы).
Гомологический ряд:

фенол, гидроксибензол (карболовая кислота)
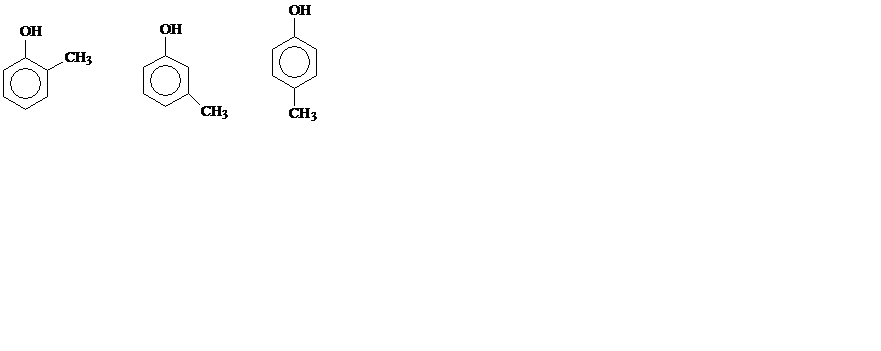
о-крезол м-крeзол п-крезол
СН3С6Н4ОН – крезолы (метилфенолы, гидрокситолуолы).
Физические свойства. Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления.
Химические свойства фенолов обусловлены наличием вих молекулах функциональной группы – ОН и бензольного кольца.
Реакции с участием гидроксильной группы.
I. Кислотные свойства. Фенол диссоциирует вводных растворах с образованием фенолят-ионов и ионов водорода.
1. Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов):

фенолят натрия
2. Взаимодействие с активными металлами (сходство со спиртами):
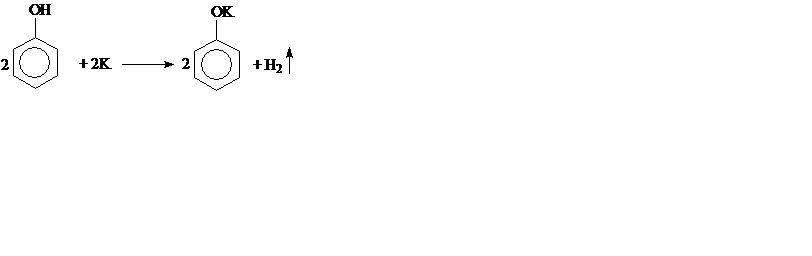
II. Реакции замещения (SE). Реакции замещения в бензольном кольце фенолов протекают легче, чем у бензола, и в более мягких условиях.
1. Галогенирование:
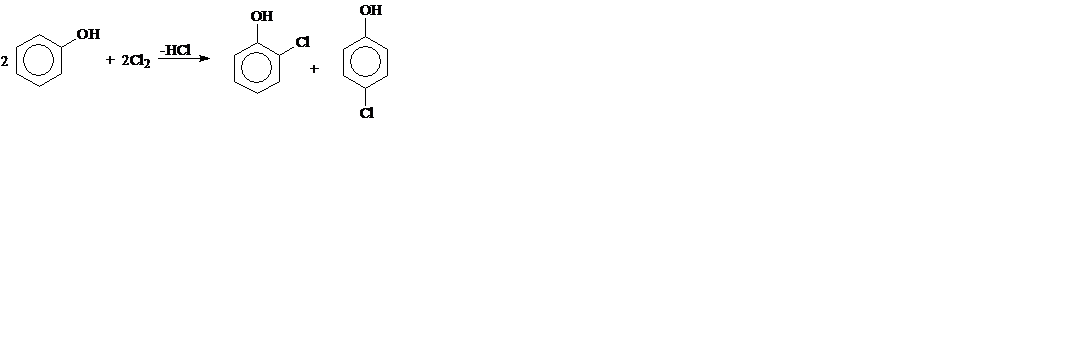
о-хлорфенол п -хлорфенол
2. Нитрование:
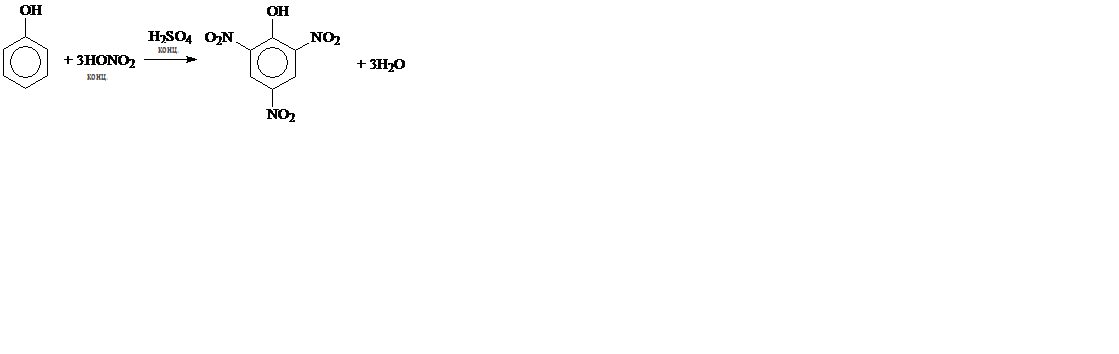
2,4,6-тринитрофенол (пикриновая кислота)
3. Сульфирование:
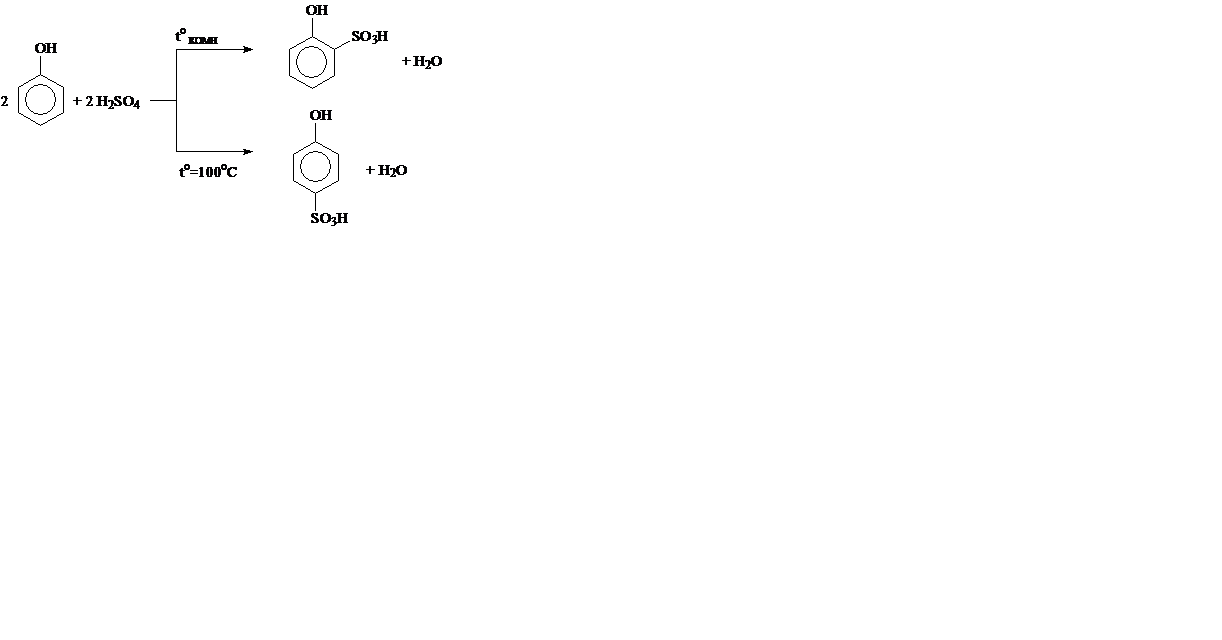
III. Реакции присоединения (A).
1. Гидрирование:
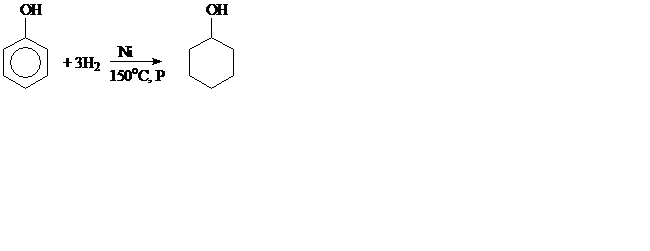
циклогексанол
Качественные реакции на фенолы – взаимодействие растворов одноатомных фенолов с хлоридом железа (III) FeCl3 с образованием комплексных фенолятов, которые имеют фиолетовую окраску.
Получение фенолов.
1. Из каменноугольной смолы. Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем – кислотой:


2. Кумольный способ.
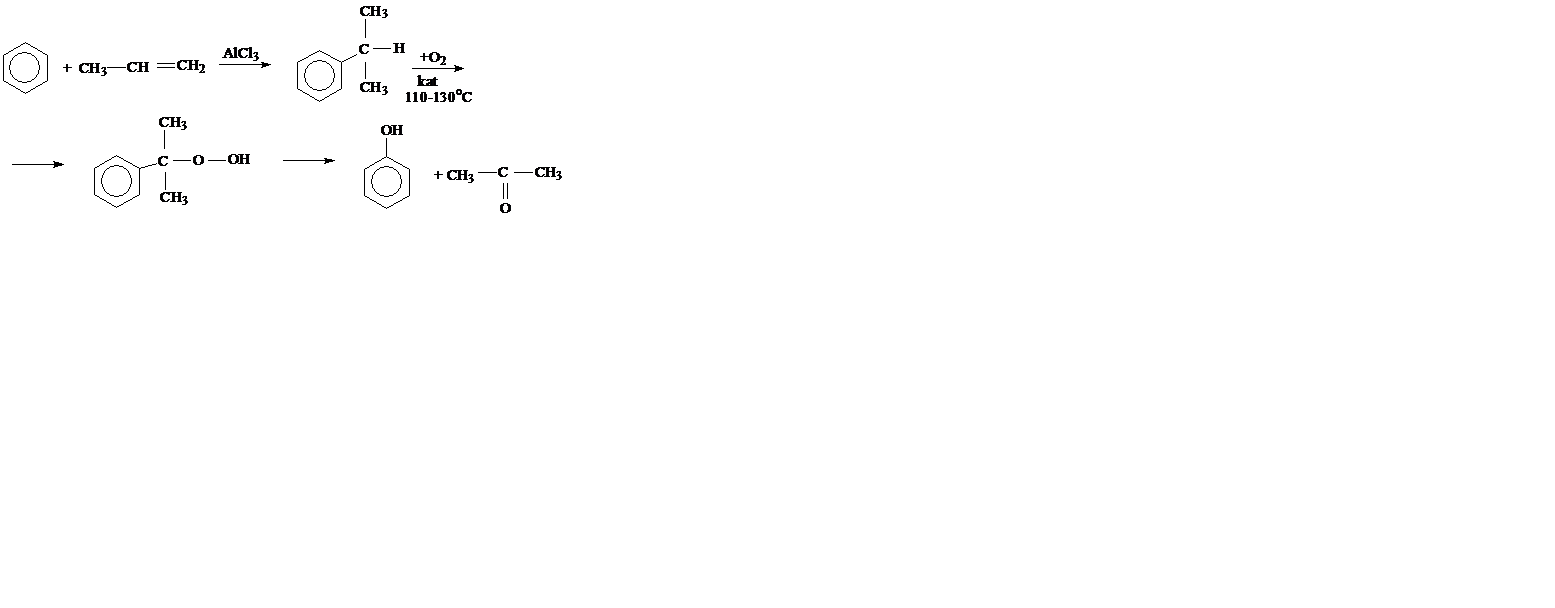
В результате этих процессов получают два промышленно важных продукта – фенол и ацетон.
3. Сплавление солей аренсульфокислот со щелочью:
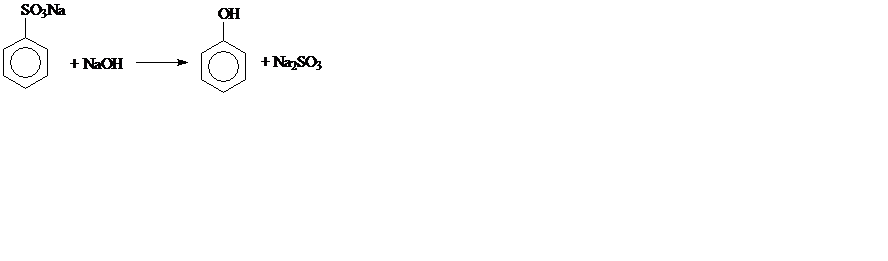
4. Взаимодействие галогенпроизводных ароматических УВ со щелочами:

или с водяным паром

 2018-01-21
2018-01-21 1927
1927








