Для кислотного буферного раствора;

Для основного буферного раствора;

Где С а (С b)-концентрация раствора кислоты(основания)
C s -концентрация раствора соли
V a (V b) –объем раствора кислоты(основания)
V s -объем раствора соли
 =-lgK a – кислотный показатель
=-lgK a – кислотный показатель
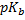 =-lgK b – основной показатель
=-lgK b – основной показатель
Буферная ёмкость - это величина характеризующая способность буферного раствора противодействовать изменению реакции среды при добавлении сильных кислот или сильных оснований.


C a- концентрация эквивалента сильной кислоты
V a- объем добав. сильной кислоты
Факторы влияющие на буферную емкость раствора
1) Концентрация компонентов
2) Отношение концентрации компонентов
При разбавлении буферная емкость уменьшается чем больше концентрация компонентов буфера тем больше буферная емкость.
Самой большой буферной емкостью и по кислоте и по щелочи обладает буферная система, когда соотношение компонентов =1.
Белковая буферная система - главный внутриклеточный буфер. Он составляет примерно 3 четверти буферной емкости внутриклеточной жидкости.
Компонентами белкового буфера явл-сяслабодисациирующий белок с кислыми св-ми (белок СООН) и соли сильного основания (белок COONa).При нарастании уровня кислот они взаимодействуют с солью белка с образованием нейтральной соли и слабой кислоты. При увеличении концентрации оснований реакция их происходит с белком с кислыми св-ми. В рез-те вместо сильного основания образуется слабоосновная соль.
Гемоглобиновая буферная система {HHb«H++Hb-; KHb«K++Hb - обладает самой большой величиной буферной емкости. Действует в эритроцитах крови. Ее буферная емкость (b) составляет 75% от всей буферной емкости крови.
Оксигемоглобиновая буферная система {HHbO2«H++HbO2-; KHbO2«K++HbO2- имеет такую же величину буферной емкости, как и гемоглобиновая буферная система.
Эфиры глюкозы и фосфорной кислоты различной степени замещения {Г-PO3Na2; Г-PO3NaH. Она способствует сохранению постоянства pH в организме.
Карбонатная буферная система {H2CO3«H++HCO3-; NaHCO3«Na++HCO3-. Характеризует кислотно-щелочной резерв крови. Действует в плазме крови и в эритроцитах.
В медицине кислотно-щелочное равновесие организма оценивают с помощью уравнения Гендерсона-Гассельбаха, выведенного для карбонатного буфера:
pH=pK+lg([HCO3-]/[H2CO3]).
Опытным путем было найдено, что в крови здорового человека pK=6,11 и pH=7,34-7,36, рабочая формула крови человека: pH=6,11+lg([HCO3-]/[CO2]).
Т.е., благодаря буферному действию вышеуказанных систем pH крови в норме практически не меняется, несмотря на поступление извне значительных количеств сильных кислот и щелочей.
Ацидоз-смещение кислотно-щелочного баланса организма в сторону увеличения кислотности.
Алкалоз-увеличение рН крови за счет накопления щелочных веществ.
Щелочной резерв крови: представляет собой объем(мл) химически связанного диоксида углерода СО2 (главным образом в виде гидрокарбонатов) в 100 мл плазмы крови; измеряется в объемных процентах; в норме составляет 50-70 объемных процентов (25-30 моль/л).
2))) a -аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один из атомов водорода замещен аминогруппой (NH2). Общее число АК достигает 300, но из них выделяют группу 20-ти наиболее важных a -АК, встречающихся в составе белков животного и растительного происхождения.
Для аминокислот характернастереоизомерия. Асимметричным является a-углеродный атом, т.к. с ним связаны четыре различные химические группы, в этом случае для каждой a-аминокислоты существует две возможные конфигурации – D- и L-энантиомеры. В белках встречаются только L-изомеры a-аминокислот. Это имеет важнейшее значение для формирования пространственной структуры белков и проявления ими биологической активности. С этим непосредственно связанастереоспецифичность действия ферментов.
 2018-01-21
2018-01-21 697
697







