Ацидоз-смещение кислотно-щелочного баланса организма в сторону увеличения кислотности.
Алкалоз-увеличение рН крови за счет накопления щелочных веществ.
Щелочной резерв крови: представляет собой объем(мл) химически связанного диоксида углерода СО2 (главным образом в виде гидрокарбонатов) в 100 мл плазмы крови; измеряется в объемных процентах; в норме составляет 50-70 объемных процентов (25-30 моль/л).
3. Карбоновыми кислотами называют соединения, функциональной группой в которых является карбоксильная группа СООН.
Карбоновые кислоты классифицируют по количеству карбоксильных групп на:
1. одноосновные или монокарбоновые кислоты, содержащую одну карбоксильную группу:
НСООН – муравьиная кислота (метановая);
СН3СООН – уксусная кислота (этановая);
СН3СН2СООН – пропионовая кислота (пропановая);
СН3(СН2)2СООН – масляная кислота (бутановая);
СН3(СН2)3СООН – валериановая (пентановая);
СН3(СН2)4СООН - капроновая (гексановая)
С17H35COOH–стеоринова кислота
С17Н33СООН – пальметиновая кислота
С17Н31СООН-линолевая кислота
С17Н29СООН-линоленовая кислота
Поликарбоновые кислоты, содержащие 2 или более карбоксильные группы.
R-COOH- происходит смещение эл. Плотности от атома углерода карбонильной группе к атому кислороду. В составе карбоксильной группы есть два атома кислорода его отрицательный заряд в следствии сопряжаетсяделаколизируется и равномерно распределяется м/у двумя атомами кислорода что повышает устойчивость аниона и экранирует положительный заряд на атоме углерода карбоксильной группе поэтому для карбоксильной группы не хар-ны реакции нуклеофильного присоединения для них хар-ны реакции нуклеофильного замещения.
Ацилирование-это ввод в молекулу органического соед. остатка карбоксильной кислоты ацила.
Реакция ацилирования:
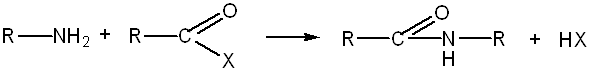
Ацилфосфаты играют важную роль в биохимических процессах как переносчики ацильных групп, например ацетилфосфат.
Ацетилкофермент А – образуется при взаимодействии кофермента А с ацетиладенилатом, представляющеий собой замещенный ацетилфосфат.
Билет 11
1)Электролитическая диссоциация – процесс распада электролита на ионы при его растворении или плавления.
Диссоциация в растворах:
Диссоциация на ионы в растворах происходит в следствии взаимодействия растворенного вещества с растворителем: по данным спектроскопических методов, это взаимодействие носит в значительной мере химический характер. Наряду с сольватирующей способностью молекул растворителя определяющую роль в электролитической диссоциации играет также макроскопическое свойство растворителя – его диэлектрическая проницаемость.
Диссоциация при плавлении:
Под действием высоких температур ионы кристаллической решетки начинают совершать колебания, кинетическая энергия повышается, и наступит такой момент (при температуре плавления вещества), когда она превысит энергию взаимодействия ионов. Результатом этого является распад вещества на ионы.
Закон разведения Оствальда: Степень диссоциации слабых бинарных электролитов обратно пропорциональна корню квадратному из их концентрации или прямо пропорциональна корню квадратному из разведения:
K=Ca2/1-α, K=Ca2 =>α=±√K/C
Теория сильных электролитов:
Сильные электролиты – химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также растворителях, обладающих высокой диссоциирующей способностью (спирты амиды и др.). Примеры сильных электролитов: некоторые кислоты (HClO4, HMnO4, H2SO4, HCl, HBr, HJ), гидроксиды щелочных и щелочноземельных металлов (NaOH, KOH, Ba(OH)2, большинство солей.
Кислотно-основное равновесие – относительное постоянство соотношения кислота – основание внутренней среды живого организма, является составной частью гомеостаза. Кислотно-основное равновесие, обеспечивающее постоянство значении рН водных растворов организма, необходимое для нормального протекания биохимических процессов, обеспечиваются буферными системами жидкостей организма.
Согласно протолитической теории Бернстеда-Лоури, кислотами называют вещества, отдающие протоны, а основаниями – вещества, принимающие протоны. Протон не может существовать в растворе самостоятельно, он должен быть принят основанием, поэтому, чтобы кислота могла отдать протон, необходимо присутствие основания, к которому протон переходит. Таким образом, возникают кислотно-основные пары, которые называют сопряженными.
Константа диссоциации воды, равная произведению концентрации протонов гидроксид-ионов, называется ионным произведением воды.
Водородный показатель (pH)- количественная мера характеристика кислотности среды, равная отрицательному десятичному логарифму концентрации свободных ионов водорода в растворе
Колометрический метод определения pH -в основном сводится к подбору ряда индикаторов с различным значением pH, зона перемены окраски которая могла бы охватывать значения рН в пределах от 0 до 14
Сильные электролиты – все кислоты и основания, константы ионизации которых больше 10–2.
В водных растворах концентрации ионов Н+ и ОН– взаимосвязаны выражением ионного произведения воды
Кв = Кд×[H2O] = 1,8×10–16×55,49 = 10–14
[H+] × [OH–] = 10–14
Концентрации ионов Н+ (ОН–) и, следовательно, рН растворов слабых кислот (оснований) определяется не только концентрацией раствора, но и константой ионизации кислоты (основания), т.е. природой электролита.
2) Родственные классы альдегидов и кетонов содержат функциональную карбонильную группу и относятся к карбонильным соединениям. Для них также используется общее название оксосоединения, так как группа =О называется оксогруппой.
Альдегидами называют соединения, в которых карбонильная группа связана с органическим радикалом и атомом водорода:
О
||
R – C – H
Кетонами называют карбонильные соединения с двумя органическими радикалами:
O
||
R – C – R’
Электронное строение карбонильной группы;
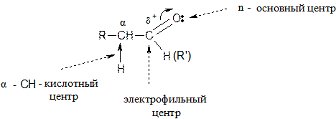
В молекулах альдегидов и кетонов присутсвуют несколько реакционных центров:
1) Электрофильный центр – атом углерода карбонильной группы – предопределяет возможность нуклеофильной атаки;
2) Основной центр – атом кислорода – обуславливает возможность атаки протоном;
3) СН – кислотный центр, атом водорода которого обладает слабой протонной подвижностью и может, в частности, подвергаться атаке сильным основанием.
В целом альдегиды и кетоны обладают высокой реакционной способностью.
Легкость нуклеофильной атаки по атому углерода карбонильной группы альдегида или кетона зависят от величины частичного положительного заряда на атоме углерода, его пространственной доступности и кислотно-основных свойств среды
Пространственная доступность карбонильного атома углерода уменьшается при замене водорода более объемистыми органическими радикалами, поэтому альдегиды более реакционноспособны, чем кетоны.
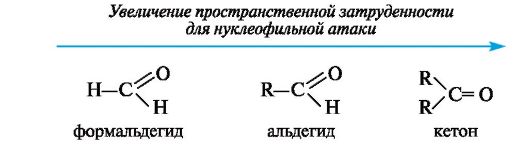
Общая схема реакции нуклеофильного присоединения АNк карбонильной группе включает нуклеофильную атаку по карбонильному атому углерода, за которой следует присоединения электрофила к атому углерода
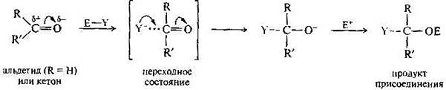
ГАЛОФОРМНАЯ РЕАКЦИЯ (галоформное расщепление), расщепление соед., содержащих ацетильную группу, под действием щелочи и галогена(или гипогалогенита) на карбоновые к-ты, в молекулах к-рых на один атом С меньше, чем в исходном соед., и на галоформ(хлороформ, бромоформ или йодоформ). 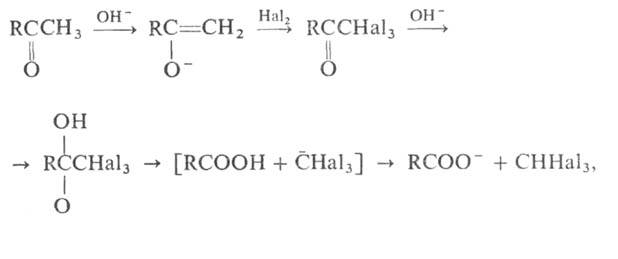
Билет 12.
1) Раствор – это физико-химическая система, состоящая из двух или большего числа веществ и имеющая переменный состав в некотором интервале соотношения компонентов.
Велика роль растворов в процессах жизнедеятельности. Кровь, лимфа, желудочный сок, кишечный сок и другие биологические жидкости являются растворами. В жидких средах организма поддерживается постоянство pH, концентрации солей, органических веществ. Такое постоянство называется концентрационным гомеостазом.
Растворы классифицируются по следующим признакам:
I. По агрегатному состоянию они делятся:
жидкие растворы (кровь, желудочный сок, растворы кислот, солей, щелочей);
газообразные растворы (воздух, наркозные смеси);
твердые растворы (сплавы различных металлов).
II. По размеру частиц растворенного вещества:
истинные растворы с размерами частиц меньше 10-9 м;
коллоидные растворы и растворы ВМС с размерами частиц от 10-9 до 10-7 м.
Истинные растворы и растворы ВМС гомогенны и термодинамически устойчивы. Коллоидные растворы микрогетерогенны и термодинамически неустойчивы.
III. По молярной массе растворенного вещества:
растворы НМС – веществ с молярной массой Mr< 5000 г/моль;
растворы ВМС – веществ с молярной массой Mr> 5000 г/моль.
IV. По наличию или отсутствию электролитической диссоциации:
Растворы электролитов (растворы многих неорганических соединений – кислот, солей, щелочей). Их электропроводимость больше электропроводимости чистого растворителя.
Растворы неэлектролитов – растворы многих органических соединений. Их электропроводимость мало отличается от электропроводимости чистого растворителя.
Растворы амфолитов, т.е. веществ, которые диссоциируют как по кислотному, так и по основному типу (напр., a-аминокислоты).
Концентрация раствора- это величина измеряемая количеством растворенного вещества в определенном объеме или массе раствора(растворителя).
Растворы неэлектролитов - это растворы не проводящие электрический ток, в которых растворенное вещество находится в виде молекул (растворы глюкозы, фруктозы, сахарозы, пероксида водорода).
Коллигативные свойства растворов -это свойства относительные характеристики которых не зависят от природы частиц а определяются только их числом.
Коллигативные свойства растворов:
Понижение давления насыщенного пара растворителя над раствором по сравнению с давлением насыщенного пара чистого растворителя;
Повышение температуры кипения растворов нелетучих веществ по сравнению с температурой кипения чистого растворителя;
Понижение температуры замерзания растворов по сравнению с температурой замерзания чистого растворителя;
Осмос и осмотическое давление.
Диффузия-это самопроизвольный процесс переноса частиц растворенного вещества, который осуществляется при наличии градиента концентрации растворенного вещества и приводит к выравниванию концентрации этого вещества по всему объему раствора.
Скорость диффузии-это количество вещества, переносимого за счет диффузии через единицу площади поверхности в единицу времени.
Факторы, влияющие на скорость диффузии:
Градиент концентраций, температура, вязкость среды, размер частиц.
Значение диффузии в биологических процессах:
Перемещение питательных веществ и продуктов обмена в организме;
Определяющая роль диффузии как лимитирующий(самой медленной)стадии в общей кинетике биохимических процессов;
Доставка лекарственных веществ к органам и тканям организма.
Осмос-это направленный самопроизвольный переход молекул растворителя через мембрану из раствора с меньшей концентрацией растворенного вещества в раствор с большей концентрацией.
Осмотическое давление(п)-это давление, которое надо приложить к раствору, чтобы прекратить осмос.
Закон Вант-Гоффа: Осмотическое давление разбавленного раствора при данной температуре прямо пропорционально молярной концентрации растворенного вещества.
пи=CRT, где С-молярная концентрация раствора, моль/л.
R-постоянная величина, совпадающая с универсальной газовой постоянной равная 8,314 Дж/(мольК)
Т-температура К.
Растворы электролитов-это растворы проводящие электрический ток в которых растворенное вещество находится преимущественно в виде ионов(растворы хлорида натрия,сульфатамагния,гидрокарбонатанастрия,перманганата калия).
Закон Рауля: Относительное понижение давления насыщенного пара над разбавленным раствором нелетучего неэлектролита не зависит от природы растворенного вещества и равно его мольной доле в растворе.
Первое следствие из закона Рауля: понижение температуры замерзания раствора по сравнению с температурой замерзания растворителя прямо пропорционально молярной концентрации растворенного вещества.
ΔТзам=К*в(х), где в(х)-молярность растворенного вещества в растворе, моль/кг;
К-криоскопическая постоянная растворителя, К*кг/моль;
ΔТзам=Тзам(р-ля)-Тзам(р-ра)
Второе следствие из закона Рауля: Повышение температуры кипения раствора по сравнению с температурой кипения растворителя прямо пропорционально молярной концентрации растворенного вещества.
ΔТ кип=Е*в(х), где Е-эбуллиоскопическая константа растворителя, К*кг/моль;
ΔТ кип=Ткип(р-ра)-Ткип(р-ля)
Изотонический коэффициент I – это эмпирический коэффициент, вводимый для учета межмолекулярных взаимодействий в неидеальных растворах i =N i / N o.
Изотонические растворы-это растворы с одинаковым осмотическим давлением.
Гипертонический раствор-это раствор с большим осмотическим давлением чем у стандартного раствора.
Гипотонический раствор-это раствор с меньшим осмотическим давлением чем у стандартного раствора.
Гемолиз- это набухание и разрыв клеток в сильно гипотоническом растворе.
Плазмолиз-это сжатие сморщивание клеток в гипертонической среде.
Амины – органические соединения, содержащие в своем составе аминогруппу. С одной стороны амины можно рассматривать как производные аммиака в котором один или несколько атомов водорода замещены на органические радикалы. В зависимости от числа замещенных атомов водорода различают первичные, вторичные, третичные амины. Следует обратить внимание на иное использование этих понятий, они обозначают число атомов углерода, с которыми непосредственно связан атом азота. В зависимости от природы органических радикалов амины могут относиться к алифатическому, ароматическому или гетероциклическому ряду, а также быть смешанными. За счет наличия неподеленной пары электронов у атома азота все амины являются слабыми основаниями. Аммиак и амины участвуют в реакциях нуклеофильного замещения как нуклеофилы. Так при действии избытка аммиака алкилгалогениды превращаются в первичные амины. При избытке алкилгалогенида образовавшийся на первой стадии первичный амин превращается затем во вторичный и далее третичный амины, и, наконец, соль тетраалкилзамещенного аммония. Все эти реакции могут рассматриваться как реакции алкилирования аммиака и аминов алкилгалгогенидами. Важным превращением первичных аминов является удаление из них молекулы аминогруппы – реакция дезаминирования. В лабораторных условиях для этого используется азотистая кислота в кислой среде. Первичный амин при этом превращается в спирт.
Азосоединения – класс органических соединений, содержащих одну (или больше) аминогрупп. Простейшее – азобензол.
Диазосоединения – общее название органических веществ, содержащих группировку из двух атомов азота, связанную с одним атомом углерода.
13-билет
1)Химическая кинетика изучает механизм и скорость химических превращений.
Скорость химических реакций - это число элементарных взаимодействий, происходяших в единицу времени в единице объема гомогенной системы или на единице поверхности раздела фаз гетерогенной системы. Скорость хим.реакции характеризуют изменением концентрации вещества в системе на единицу времени. Различают среднюю и истинную скорость реакций. Средняя скорость реакции определяется изменением концентрации реагирующего вещества или продукта реакции за любой промежуток времени. Мгновенная или истинная скорость реакции- первая производная изменения концентрации вещества во времени., характеризуется изменением концентрацц\ии за бесконечно малый промежуток времени.
Влияние концентрации вещества на скорость реакции сформулировано в основном постулате химической кинетики законе действующих масс: скорость химических реакций при данной температуре прямо пропорциональна произведению концентраций реагирующих веществ в степени соответствующих стехиометрических коэффициентов
В химической кинетике химические реакции классифицируют: по молекулярности, по порядку реакции
Молекулярность химического процесса определяется числом молекул, участвующих в элементарном химическом взаимодействии. По молекулярности различают мономолекулярные и бимолекулярные.
Порядок реакции определяется кинетическим уравнением и равен сумме показателей степеней при концентрациях этих уравнений.
Реакции нулевого порядка, которые характеризуются постоянной скоростью и отвечают уравнению вида n=k, где скорость реакции не зависит от концентрации веществ.
реакции первого порядка, которые характеризуются уравнением n=kCa. Это может быть в случае мономолекулярных реакций или на конечных стадиях биохимических процессов.
реакции второго порядка, характеризующиеся уравнением вида n=kCaCb. Это справедливо для реакций соединения, обмена, в случае примерного равенства концентраций реагирующих веществ.
Правило Вант-Гоффа(1884): при повышении температуры на 10 градусов скорость гомогенной химической реакции увеличивается в 2-4 раза (в среднем в 3 раза).
Vt2=Vt1·g^((t2-t1)/10), где:
g - температурный коэффициент Вант–Гоффа, показывающий, во сколько раз изменится скорость реакции при увеличении температуры на 10°С (2-4).
Для некоторых биохимических процессов (денатурация белков) температурный коэффициент по значению выше (7-8), что означает
сверхчувствительность процессов к изменениям температуры.
Температурные границы жизни лежат в пределах от 10 до 50°С. Это обусловлено денатурационными изменениями в белковых молекулах и инактивацией ферментов.
Катализ – это изменение скорости реакции в присутствии особых веществ – катализаторов, участвующих в процессе, но остающихся к концу реакции химически неизменёнными.
Действие катализатора основано на образовании между ними и реагирующими веществами комплекса с пониженным уровнем энергии активации в случае положительного катализа или повышенным уровнем энергии активации в случае отрицательного катализа.
По механизму действия различают катализы:
Гомогенный - Если катализатор находится в той же фазе, что и реагирующие вещества, то такой катализ называется гомогенным.
Гетерогенный - Если катализатор и реагирующие вещества находятся в разных фазах, то такой катализ называется гетерогенным.
ферментативный
Химические свойства спиртов — это химические реакции спиртов во взаимодействии с другими веществами.
Они определяются в основном наличием гидроксильной группы и строением углеводородной цепи, а также их взаимным влиянием:
Чем больше углеводородная цепь, тем сильнее она влияет на функциональную группу, снижая полярность связи O—Н. Реакции, основанные на разрыве этой связи, протекают медленнее.
Гидроксильная группа −ОН уменьшает электронную плотность вдоль прилегающих σ-связей углеродной цепи (отрицательный индуктивный эффект).
Все химические реакции спиртов можно разделить на три условные группы, связанные с определёнными реакционными центрами и химическими связями:
Разрыв связи O−H (реакционный центр — водород);
Разрыв или присоединение по связи С−OH (реакционный центр — кислород);
Разрыв связи −СOH (реакционный центр — углерод).
Спирты имеют аномально высокие температуры кипения. За счет образования водородных связей с молекулами воды спирты хорошо в ней расторимы. Неподеленная пара электронов атома кислорода обусловливает слабые основные свойства спиртов и они образуют оксониевые соли с сильными минеральными кислотами. Связь С-О в спиртах полярная и способна к гетеролитическому разрыву. В ходе реакции нуклеофильного замещения атакующий реагент (нуклеофил) отдает субстрату свою пару электронов, за счет которой образуется связь между атомами углерода субстрата и нуклеофилом, а уходящая группа (нуклеофуг) отщепляется со своей парой электронов. Данный процесс можно рассматривать также как алкилирование. 
14-билет
1.второй закон термодинамики, который утверждает, что все природные и технологические процессы самопроизвольно могут протекать только в одном направлении, стремясь к состоянию равновесия.
Пр.: а) теплота передается от горячего к холодному; б) растворенные вещества равномерно распределяются по всему объему раствора.
1. Теплота не может сама собой передаваться от холодного тела к горячему, не оставляя изменения в окружающей среде.
2. Различные виды энергии стремятся перейти в теплоту, а теплота в свою очередь стремиться рассеивается, т.е. теплоту невозможно полностью превратить в полезную работу.
Термодинамические процессы могут быть обратимыми и необратимыми:
Обратимые – процессы, при которых возвращение системы в первоначальное состояние не требует затраты энергии извне и связанных с этим изменений в окружающей среде. При обратимом осуществлении процесса не происходит рассеяния энергии в виде теплоты. Если этот обратимый процесс осуществляется в изолированной системе, то он не сопровождается каким-либо изменением энтропии.
Необратимые – процессы, при которых возвращение системы в исходное состояние возможно лишь при условии затрат внешней энергии, что влечет за собой определенные изменения в окружающей среде.
Энтропия(S) - мера неупорядоченности системы.
Ростом энтропии сопровождаются такие самопроизвольные процессы, как испарение жидкости, таяние льда,растворение веществ в растворителях, т.е. процессы, которые приводят к увеличению беспорядка в системе.
Снижением энтропии сопровождаются кристаллизация веществ, реакции полимеризации, поликонденсации, т.е. процессы, которые приводят к увеличению упорядоченности в системе.
Энергия Гиббса. (G).
1. Энергия Гиббса – это часть потенциальной энергии реагирующих веществ, которая может быть использована для осуществления полезной работы. Del’ta G=del’ta H-T*del’ta S
Энтальпийный фактор.
Определяет стремление системы снизить свою энергию за счет образования сложных частиц из более простых, при этом совершается полезная работа.
Энтропийный фактор.
Определяет стремление системы к хаотичному, неупорядоченному состоянию, за счет распада сложных частиц на более простые и распределению их по всему объему системы.
Величина DG служит критерием возможности самопроизвольного протекания процессов.
Процесс протекает самопроизвольно, если DG<0.
При DG>0, процесс самопроизвольно не протекает.
Если DG=0, то в системе установилось состояние равновесия.
Живой организм представляет собой типично открытую систему непрерывно обменивающуюся с окружающей средой и веществом и энергией. Все биохимические процессы, происходящие в клетках живых организмов, протекают в условиях постоянства температуры и давления. Человеческий организм – как и любой живой организм – открытая термодинамическая система. Основной источник энергии для него – химическая энергия, заключенная в пищевых продуктах.
Процессы, при которых в условиях p=const и T=const – энергия Гиббса, а при V=const, T=const - энергии Гельмгольца убывают – называют экзэргоническими, а процессы, при которых эти величины возрастают - эндэргоническими.
Состояние химического равновесия характеризуется законом действующих масс, который утверждает, что для реакции общего вида: a моль вещества A + b моль вещества B = c моль вещества C + d моль вещества D, в состоянии химического равновесия при постоянстве внешних условий, отношение произведения концентраций продуктов на произведение концентраций реагентов, взятых с учетом стехиометрического количества, есть величина постоянная и называется константой химического равновесия (КС);
КС=([Cc][Dd])/([Aa][Bb])
Константа равновесия зависит от температуры и природы реагирующих веществ, не зависит от концентрации.
То, или иное поведение равновесной системы, направление сдвигов, происходящих в ней под влиянием изменения разных факторов может быть предсказано на основе принципа Ле-Шателье – Брауна: если на систему, находящуюся в истинном термодинамическом равновесии, воздействовать извне, изменяя при этом одно из условий, определяющих положение равновесия (t,p,C), то в системе развиваются процессы, смещающие равновесие в том направлении при котором эффект произведенного воздействия будет ослаблен.
2)Ненасыщенные углеводороды - алкены, циклоалкены, алкадиены и алкины – проявляют способность к реакциям присоединения, так как содержат двойные или тройные связи. Более важной является двойная связь. За счет электронов П-связи в молекулах алкенов имеется область повышенной электронной плотности. Поэтому они представляют собой нуклеофилы, и следовательно, склонны подвергаться атаке электрофильным реагентом. Присоединение к алкенам (гидрирование, галогенирование, гидрогалогенирование, гидратация(в кислой среде)
Правило Марковникова: при присоединений протонных кислот или воды к несимметричнымалкенам водород присоединяется к наиболее гидрогенизированному атому углерода двойной связи, т.е. атому углерода, содержащему большее число атомов водорода. Сформулировано в 1869 году.
Сопряженными - называются системы с чередующимися простыми и двойными связями, или системы, в которых у соседнего с двойной связью гетероатома имеется р-орбиталь с неподеленной парой электронов. Для ароматических соединений бензольного ядра, конденсированных и гетероциклических ароматических соединений характерны реакции, не приводящие к нарушению ароматической системы, т.е. реакции замещения. Они не склонны вступать в реакции присоединения или окисления, ведущие к нарушению ароматичности
Реакции электрофильного замещения: Галогенирование(в присутствии FeBr3), нитрование (в присутств H2SO4), сульфирование, алкилирование, ацилирование.
При взаимодействии бензола с электрофилом равновероятна атака любого из шести равноценных атомов углерода ароматического кольца, что всегда приводит к единственному монозамещенному продукту. В случае монозамещенного бензола в общем возможно образование трех изомеров – продуктов орто-, мета, и пара-замещения. По влиянию на реакции электрофильного замещения заместители делятся на две группы:
1) Заместители(ориентанты) 1 рода. К ним относятся алкильные группы, проявляющие +I эффект по отношению к соседнему sp2гибридизованному атому углерода и проявляющие +М эффект группы OH, OR, NH2, также обладающие ЭД характером по отношению к бензольному кольцу. Заместители 1 рода облегчают электрофильное замещение по сравнению с незамещенным бензолом,т.е. являются активирующими, и направляют входящую группу в орто-и пара-положения.
2)заместители 2 рода. К ним относятся группы NH3, NO2, SO3H, CN, CHO,COOH, проявляющие по отношению к кбензольному ядру ЭА характер за счет отрицательных индуктивного или мезомерного эффектов. Заместители 2 рода затрудняют реакции электрофильного замещения по сравнению с незамещенным бензолом, т.е. являются дезактивирующими. Если в более жестких условиях реакция се же проходит, то входящая группа вступает в мета-положение.
15-билет
1) Энергия в системе не создается из ничего, и не исчезает бесследно. Термодинамика как научная дисциплина сложилась в начале 19 века на основании данных по изучению перехода теплоты в механическую работу. Термодинамика – это наука, изучающая взаимные превращения различных видов энергии, связанные с переходом энергии в форме теплоты и работы.
Раздел этой науки, изучающий хим. Реакции, фазовые переходы, растворение, испарение, адсорбцию, взаимосвязь химической и других видов энергии, а также переход энергии от одной части системы к другой в различных химических процессах называется химической термодинамикой. Обмен веществ(метаболизм) происходящий в живом организме, включающий громадное количество непрерывно протекающих и взаимосвязанных реакций, также неразделим с соответствующим ему процессом обмена энергии. Совокупность процессов, приводящих к накоплению веществ в организме называется ассимиляцией(анаболизмом). Параллельно ему и неразрывно с ним протекает противоположный ему процесс диссимиляции или катаболизма, сводящийся к деструктурированию сложных хим.соединений и выделению энергии. Превращение энергии, происходящие в живых организмах, обусловленные протеканием как анаболических, так и катаболических процессов, является предметом биоэнергетики.
Термодинамическая система (ТД система) – любая избранная совокупность веществ, отделенная от внешней среды определенной поверхностью раздела. Часть объектов природы, не входящих в систему, называются средой. Состояние и свойства системы определяются термодинамическими параметрами, к которым относятся температура (t), давление (р), объем (V), концентрация (с).
В зависимости от характера взаимодействия с окружающей средой, ТД системы делятся на следующие виды:
1. Изолированные системы – системы, которые не обмениваются с окружающей средой ни массой, ни энергией. (Dm=0, DЕ=0). Пример: термос.
2. Закрытые системы - обмениваются с окружающей средой только энергией. Для них Dm=0, аDЕ¹0. Пример: запаянная ампула с лекарством.
3. Открытые системы. Обмениваются с окружающей средой и m, и Е. Для них Dm¹0, DЕ¹0. Пример: живой организм.
Фаза – это часть системы с одинаковыми физическими и химическими свойствами, отделенная от других частей границей раздела, при переходе через которую свойства резко меняются. В зависимости от фазового состояния различают:
1. Гомогенные системы. Это системы, в которых все компоненты находятся в одной фазе, и в них отсутствуют границы раздела. Пример: раствор глюкозы.
2. Гетерогенные системы. Они состоят из нескольких фаз, отделенных границей раздела. Пример: эритроциты – плазма крови.
Изохорный процесс – постоянство объема
Изобарный процесс – постоянство давления
Первый закон термодинамики: теплота, подведенная к системе расходуется только на увеличение внутренней энергии системы и на совершение ею работы против внешних сил.нуклеофильные центры. Q=del’taU+A
Внутренняя энергия(U) – энергии, все кроме кинетической (перемещение всей системы в целом), и потенциальная (взаимодействие системы с внешними силами).
Энтальпия(H) – это часть внутренней энергии системы, которая может совершить полезную работу.H=U+pV
Закон Гесса: тепловой эффект реакции зависит только от природы и состояния исходных веществ, и не зависит от пути, по которому реакция протекает. 1-е следствие: тепловой эффект реакции равен сумме теплот образования продуктов реакции минус сумма теплот образования исходных веществ. 2-е следствие – теплота образования органического соединения равна разности между теплотой сгорания простых веществ, из которых оно может быть получено и теплотой сгорания самого соединения. Уравнения химических реакций, в которых помимо формул исходных веществ и продуктов реакции указаны также отвечающие этим реакциям тепловые эффекты(изменение энтальпии) наз. термохимическими уравнениями.
2)Огромное количество органических соединений, которых в настоящее время насчитывается около 7 млн, классифицируют с цчетом строения углеродной цепи присутствующих в молекуле функциональных групп. В зависимости от строения углеродной цепиорганические соединения делят на ациклические и циклические. Ациклические – соединения с открытой(незамкнутой) углеродной цепью. Их простейшие представители – алифатические углеводороды. Алифатические углеводороды – соединения, содержащие только атомы углерода и водорода, они могут быть насыщенными(алканы) и ненасыщенными(алкены, алкины, алкадиены). Циклические – соединения с замкнутой цепью. В зависимости от природы атомов различают карбоциклические и гетероциклические. Карбоциклические – содержат только атомы углерода и делятся на алифатические циклические и ароматические. Простейший представитель алициклических – циклопропан, ароматических – бензол. Гетероциклические – содержат в цикле кромеатом углерода, один или несколько атомов других элементов – гетероатомов.
Функциональная группа – атом или группа атомов, определяющих принадлежность соединения к определенному классу и ответственная за его химические свойства.
Органический радикал – остаток молекулы, из которой удалены один или несколько атомов водорода, при этом остаются свободными один или несколько валентностей. Углеводороды обладают наиболее простым составом среди органических соединений. Реакционная способность углеводородов зависит от степени их насыщенности. Для насыщенных углеводородов характерны реакции – радикального замещения, насыщенных – электрофильного присоединения, ароматических – электрофильного замещения.
В насыщенных углеводородах алифатического(алканах) и алициклических(циклоалканах) рядов имеются только sp3– гибридизованные атомы углерода. Для этих соединений характерны неполярные C-C и практически неполярные C-H сигма связи? Обладающие достаточной прочностью и не склонные к гетеролитическому разрыву. В результате, насыщенные углеводороды инертны в большинстве гетеролитических реакций. Возможными для них остаются радикальные процессы, в которых участвуют обладающие высокой энергией радикальные частицы. Галогенирование – реакция радикального замещения, лежащая в основе одного из способов получения галогенопроизводных углеводородов. Процесс протекает по свободнорадикальному механизму. Инициирование – рост цепи – обрыв цепи.
Молекула кислорода представляет собой бирадикал и может реагировать с соединениями, содержащими C-H связи, по радикальному механизму с образованием гидропероксидов или продуктов их дальнейших превращений.
 2018-01-21
2018-01-21 252
252







