II. Окисление аминов
Амины, особенно ароматические, легко окисляются на воздухе. В отличие от аммиака, они способны воспламеняться от открытого пламени.
4СH3NH2 + 9O2 ® 4CO2 + 10H2O + 2N2
III. Взаимодействие с азотистой кислотой
Азотистая кислота HNO2 – неустойчивое соединение. Поэтому она используется только в момент выделения. Образуется HNO2, как все слабые кислоты, действием на ее соль (нитрит) сильной кислотой:
KNO2 + HCl ® НNO2 + KCl
или NO2- + H+ ® НNO2
Строение продуктов реакции с азотистой кислотой зависит от характера амина. Поэтому данная реакция используется для различения первичных, вторичных и третичных аминов.
Первичные алифатические амины c HNO2 образуют спирты:
R-NH2 + HNO2 ® R-OH + N2 + H2O
Первичные ароматические амины при повышенной температуре реагируют аналогично, образуя фенолы. При низкой температуре (около 0° С) реакция идет иначе (см. ниже, раздел 2.4).
Вторичные амины (алифатические и ароматические) под действием HNO2 превращаются в нитрозосоединения (вещества с характерным запахом):
R2NH + H-O-N=O ® R2N-N=O + H2O
|
|
|
алкилнитрозамин
Реакция с третичными аминами приводит к образованию неустойчивых солей и не имеет практического значения.
Этиламин С2Н5NH2 + HCl= 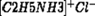
реакцией муравьиной кислоты с диметиламином
HCOOH + HN(CH3)2 →(40 °C) HCOOH*HN(CH3)2 →(120 °C) (CH3)2NC(O)H + H2O
В промышленности получают совместно с этиламином, диэтиламином при парофазном аминировании этанола аммиаком над Al2O3 или SiO2 или их смесью при 350-450 °C и давлении 20-200 атм либо над Ni, Co, Cu, Re и H2 при 150-230 °C и давлении 17-35 атм. Состав получаемой смеси зависит от исходных соотношений[1].
CH3CH2OH + NH3 = CH3CH2NH2 + H2O
CH3CH2OH + CH3CH2NH2 = (CH3CH2)2NH + H2O
CH3CH2OH + (CH3CH2)2NH = (CH3CH2)3N + H2O
 2018-01-21
2018-01-21 6500
6500








