Отчёт по лабораторной работе по химии №3.
Выполнил: студент группы I-31
Скрябин А.С.
Проверил: к.х.н.
Лукина В.Б.
Иваново 2012 г.
Лабораторная работа №2
Концентрация
Цель работы: приобретение навыков приготовления растворов. Приготовление
раствора соли с заданной массовой долей путем разбавления концентрированного раствора водой или менее концентрированным раствором того же вещества.
Теоретическая часть:
Концентрация (новолат. concentratio - сосредоточение), отношение числа частиц компонента системы (смеси, раствора, сплава), его кол-ва (молярная концентрация) или массы (массовая концентрация) к объему системы. Единицы измерения - соответственно м-3, моль/м3 или кг/м3; а также их дольные или кратные производные. Поверхностная концентрация-отношение числа частиц компонента, его кол-ва или массы на поверхности системы к площади этой поверхности; единицы измерения - соотв. м-2, моль/м2 или кг/м2. Компонентами системы м. б. частицы одного вида (напр., атомы Н, молекулы О2, ионы Na+, электроны) или одного типа (атомы щелочных элементов, молекулы оксидов РЗЭ, атомы-доноры электронов в полупроводниковых материалах и т. п.) или условные частицы (напр., эквиваленты КМnО4 при перманганатометрич. титровании в кислой среде; каждый такой эквивалент равен 1/5молекулы KMnO4). Эквивалентом называют реальную или условную частицу вещества X, которая в данной кислотно-основной реакции эквивалентна одному иону Н+ или в данной окислит.-восстановит. реакции одному электрону. В неоднородных системах различают средние (общие) и локальные концентрации компонентов.
Раствор с концентрацией, равной X моль/л, наз. X-молярным (ХМ, например 1М НСl, 0,4М КОН). Р-р, содержащий X моль/л эквивалентов, наз. X-нормальным (Хн.), например 1н. H2SO4 содержит 0,5 моль/л H2SO4). При этом обязательно указывают конкретную реакцию, для которой рассчитан эквивалент.
До введения системы СИ массовую концентрация раствора, выраженную в г/см3, называли титром раствора, а титром раствора по титруемому компоненту называли массу этого компонента, эквивалентную массе титранта, содержащегося в 1 см3 раствора. Концентрацией называли также любые формы выражения относительного содержания компонента, в частности моляльность - отношение числа молей растворенного компонента к массе растворителя в кг; массовую, объемную или мольную долю компонента - соотв. отношение его массы, объема или числа молей к общей массе, общему объему или общему числу молей всех компонентов системы. Доли компонента обычно выражали в %, а массовую долю примесей - в частях на миллион (млн-1).
Наряду с температурой и давлением концентрация является термодинамическим параметром состояния системы. Концентрация вещества -физическая величина (размерная или безразмерная), определяющая количественный состав раствора, смеси или расплава.
Наиболее распространенными способами выражения состава системы являются:
Молярная концентрация вещества В (Cв - единица моль/л) - представляет собой отношение количества растворенного вещества В к объему раствора

Термин «молярная концентрация» относится не к реально присутствующему в растворе веществу, а к веществу, использованному для получения раствора.
Молярная концентрация эквивалентов вещества В (СЭК(В), моль/л) равна отношению количества вещества эквивалентов растворенного вещества В, к объемeраствора

СЭК(В)=Zb  Cb, т.е. молярная концентрация эквивалентов вещества в Zbраз больше его молярной концентрации.
Cb, т.е. молярная концентрация эквивалентов вещества в Zbраз больше его молярной концентрации.
Произведение молярной концентрации эквивалентов вещества В и объема раствора Vp равно количеству эквивалентов этого вещества. Поэтому для реакции, в которой участвуют равные количества эквивалентов веществ А и В,
Cэк(B)Vp(B) = CэK(A)VP(A).
Моляльность вещества В в растворе (Ст(В),моль/кг) - это количество растворенного вещества В, деленное на массу (ms) растворителя:
Сm(В)= 
Моляльная концентрация не зависит от температуры, от изменения объема
раствора.
Массовая доля растворенного вещества В (- безразмерная величина) равна отношению массы растворенного вещества в
к массе раствора mp:
 =
= 
Если известны плотность (ρ) и объем раствора (Vp), то
 =
= 
1. Титр раствора вещества (Тв, г/мл) - концентрация стандартного раствора,
равная массе вещества В, содержащегося в 1 мл раствора:
 =
= 
2. Молярная доля растворенного вещества в (XB- безразмерная величина)
равна отношению количества этого вещества к суммарному количеству всех
веществ, входящих в состав раствора, включая растворитель:
 ,
, 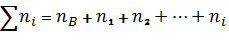
Сумма молярных долей всех веществ раствора равна единице. Если раствор состоит из растворенного вещества В и растворителя А, то
 .
.
Ход работы:
Методом интерполяции найдём плотность приготовляемого раствора.

Расчет масс исходных растворов, а также их объемов, необходимых для приготовления раствора заданной концентрации, производится по правилу смешения ("креста"):
 a1
a1
 | |||
 | |||



 a2
a2
Числа a1 иa2 показывают, в каком массовом отношении необходимо взять растворы с и соответственно: a1=  и a2=
и a2= 
V1,V2,Vx - объемы соответствующих растворов;
mx = VX  px - масса приготавливаемого раствора.
px - масса приготавливаемого раствора.
mх раствора соответствует a1+a2.
Отсюда массы исходных растворов соответственно равны
 ,
,
А объёмы:

Исходные растворы налили в бюретки, установили в них уровни растворов на нулевые отметки и налили в колбу найденные объемы растворов. Полученный раствор тщательно перемешали и вылили в мерный цилиндр (у инженера). Ареометром измерили плотность приготовленного раствора.
Расчётная часть:
Текст задачи:
1. Приготовит 50 мл 2% раствора Na2SO4 из 5% раствора Na2SO4
(  и H2O.
и H2O.
2. Рассчитать С, Сэк, См и Т Na2SO4 в полученном растворе.
1. Методом интерполяции найдём плотность приготовляемого раствора.

Расчет масс исходных растворов, а также их объемов, необходимых для приготовления раствора заданной концентрации, производится по правилу смешения ("креста"):

 a1=2%
a1=2%



a2=3%
mx = VX  px - масса приготавливаемого раствора.
px - масса приготавливаемого раствора.
mx = 50мл  1.0176г/моль=50.88г.
1.0176г/моль=50.88г.
mх раствора соответствует a1+a2.
Отсюда массы исходных растворов соответственно равны
 = 30.528г
= 30.528г
А объёмы:



Расчёт погрешности:
 =0.03%
=0.03%
2.
Вывод: на основе данных опытов приобрели навыки приготовления растворов. Научились приготавлять раствор соли с заданной массовой долей путем разбавления концентрированного раствора водой или менее концентрированным раствором того же вещества.
 2018-01-21
2018-01-21 7868
7868






