Массовая доля w В растворенного вещества В - это отношение его массы m B к массе раствора m (р):
w В = m B / m (р), где m (р) = m B + m (Н2О).
Единица массовой доли вещества в растворе - доля от единицы или от 100%.
Например, если в 100 г раствора находится 1 г KBr, то w (KBr) = 0,01 (1%). Такой раствор называют однопроцентным (1%-ный раствор KBr).
Для приготовления 100 г 1%-ного раствора некоторой соли надо взять 1 г этой соли и 99 г воды.
Плотность воды при комнатной температуре принимают равной 1 г/мл, поэтому удобнее отмерять 99 мл воды и добавить 1 г соли.
Молярная концентрация с В растворённого вещества В - это отношение количества этого вещества n В к объему раствора V (р): с В = n В / V (р). Единица молярной концентрации вещества в растворе: моль/л.
Например, если в 1 л раствора содержится 1 моль KBr, то с (KBr) = 1 моль/л. Такой раствор называют одномолярным и обозначают 1М. Аналогичным образом записи 0,1М; 0,01М и 0,001М означают деци-, санти- и миллимолярный раствор.
Для приготовления 1 л 1М раствора KBr необходимо взять навеску соли с количеством вещества 1 моль (то есть 119 г), растворить ее в воде объемом, например, 0,8 л (то есть обязательно меньше 1 л) и затем довести объем раствора до 1 л добавлением воды.
Объем раствора V (р) при данной температуре связан с массой раствора m (р) и его плотностью (ρ) следующим образом: m (р) = ρ · V (р).
Например, 100 г некоторого раствора с плотностью 1,074 г/мл (1074 г/мл) имеет объем 93,1 мл (0,0931 л).
По соотношению преобладания числа частиц, переходящих в раствор или удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. По относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, - ненасыщенным.
Насыщенный раствор содержит максимально возможное (для данных условий) количество растворенного вещества. Следовательно, насыщенным раствором является такой раствор, который находится в равновесии с избытком растворенного вещества. Концентрация насыщенного раствора (растворимость) для данного вещества при строго определенных условиях (температура, растворитель) - величина постоянная.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества, и раствор становится насыщенным.
Насыщенный и ненасыщенный растворы нельзя путать с разбавленным и концентрированным. Разбавленные растворы - растворы с небольшим содержанием растворенного вещества; концентрированные растворы - растворы с большим содержанием растворенного вещества. Необходимо подчеркнуть, что понятие разбавленный и концентрированный растворы являются относительными, выражающими только соотношение количеств растворенного вещества и растворителя в растворе.
Сравнивая растворимость различных веществ, мы видим, что насыщенные растворы малорастворимых веществ являются разбавленными, а хорошо растворимых веществ - хотя и ненасыщенные, но довольно концентрированными.
В зависимости от того, электронейтральными или заряженными частицами являются компоненты раствора, их подразделяют на молекулярные (растворы неэлектролитов) и ионные (растворы электролитов). Одна из характерных особенностей растворов электролитов заключается в том, что они проводят электрический ток.
Раствори́мость — способность вещества образовывать с другими веществами однородные системы —растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо впроцентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
12--------------------------------------------------------------------------------------------------------------------------------
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах.
 ,
,
где:
· m1 — масса растворённого вещества, г;
· m — общая масса раствора, г.
Массовое процентное содержание компонента, m%
Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.
 ,
,
где:
· V1 — объём растворённого вещества, л;
· V — общий объём раствора, л.
Как и было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили названиеспиртомеров или андрометров.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
 ,
,
где:
· νi — количество i -го компонента, моль;
· n — число компонентов;
Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации  , которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным. Примечание: единица «моль» не склоняется по падежам. После цифры пишут «моль», подобно тому, как после цифры пишут «см», «кг» ттт и т. д.
, которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным. Примечание: единица «моль» не склоняется по падежам. После цифры пишут «моль», подобно тому, как после цифры пишут «см», «кг» ттт и т. д.
 ,
,
где:
· ν — количество растворённого вещества, моль;
· V — общий объём раствора, л.
Моляльность — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.
 ,
,
где:
· ν — количество растворённого вещества, моль;
· m2 — масса растворителя, кг.
Следует обратить особое внимание, что несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
 ,
,
где:
· ν — количество растворённого вещества, моль;
· V — общий объём раствора, л;
· z — число эквивалентности (фактор эквивалентности 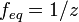 ).
).
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
13---------------------------------------------------------------------------------------------------------------------------------------
Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах.
Слабыми электролитами являются:
· почти все органические кислоты и вода;
· некоторые неорганические кислоты: HF, HClO, HClO2, HNO2, HCN, H2S, HBrO, H3PO4,H2CO3, H2SiO3, H2SO3 и др.;
· некоторые малорастворимые гидроксиды металлов: Fe(OH)3, Zn(OH)2 и др.
· Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты иоснования в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.).
· Классическая теория электролитической диссоциации применима лишь к разбавленным растворамслабых электролитов. Сильные электролиты в разбавленных растворах диссоциированы практически полностью, поэтому представления о равновесии между ионами и недиссоциированными молекулами лишено смысла. Согласно представлениям, выдвинутым в 20—30-х гг. 20 в. В. К. Семенченко (СССР), Н. Бьеррумом (Дания), Р. М. Фуоссом (США) и др., в растворах сильных электролитов при средних и высоких концентрациях образуются ионные пары и более сложные агрегаты. Современныеспектроскопические данные показывают, что ионная пара состоит из двух ионов противоположного знака, находящихся в контакте («контактная ионная пара») или разделённых одной или несколькими молекулами растворителя («разделённая ионная пара»). Ионные пары электрически нейтральны и не принимают участия в переносе электричества. В сравнительно разбавленных растворах сильных электролитов равновесие между отдельными сольватированными ионами и ионными парами может быть приближённо охарактеризовано, аналогично классической теории электролитической диссоциации, константой диссоциации (или обратной величиной — константой ассоциации). Это позволяет использовать вышеприведённое уравнение для расчёта соответствующей степени диссоциации, исходя из экспериментальных данных.
· В простейших случаях (большие одноатомные однозарядные ионы) приближённые значения константы диссоциации в разбавленных растворах сильных электролитов можно вычислить теоретически, исходя из представлений о чисто электростатическом взаимодействии между ионами в непрерывной среде — растворителе.
· Примеры сильных электролитов: некоторые кислоты (HClO4, HMnO4, H2SO4, HCl, HBr; HI), гидроксидыщелочных и щёлочноземельных металлов (NaOH, KOH, Ba(OH)2); большинство солей.
Константа диссоциации слабого электролита - величина постоянная и практически не зависит от концентрации раствора, а зависит только от температуры: Степень же диссоциации зависит от концентрации и от присутствия в растворе электролитов с одноименным ионом
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентнойэлектропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
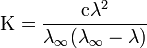
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
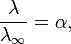
где α — степень диссоциации.
Закон разбавления Оствальда выведен В.Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации.
 2018-01-21
2018-01-21 6211
6211