Сера и ее свойства.
Сера (S) в природе встречается в соединениях и свободном виде. Распространены и соединения серы, такие как свинцовый блеск PbS, цинковая обманка ZnS, медный блеск Cu2S. Для получения серы основным источником служит железный колчедан (пирит) FeS2. Газовую серу получают из газов, образованных при коксовании и газификации угля.
Существует несколько известных аллотропных модификаций серы:
1) циклическая форма;
2) моноклинная форма;
3) кристаллическая ромбическая форма.
При температуре 20–25 °C (комнатная) наиболее устойчива желтая ромбическая сера (a-сера, r = 2,1 г/см3). При температурном интервале от 95,4 °C до 119,3 °C (температура плавления) наиболее стабильной является моноклинная сера (b-сера). При комнатной температуре кристаллы моноклинной серы постепенно переходят в монолит микроскопических кристаллов ромбической серы. При резком охлаждении сильно нагретой серы происходит образование пластической серы.
Реже встречается пурпурная сера, образующаяся при быстрой конденсации паров серы на поверхности, охлаждаемой жидким азотом.
Сера находится в VI группе третьего периода периодической системы. Имеет на внешнем электронном слое атома шесть электронов.
Проявляет степень окисления от -2 до +6.
Сера не растворима в воде, но растворима в органических растворителя х. Является диэлектриком.
Сера – неметалл с типичными для него свойствами. Взаимодействует со многими металлами непосредственно (медью, железом, цинком), выделяя при этом теплоту. Среди металлов лишь золото, платина и рутений не вступают в реакцию с серой. Взаимодействует также с большинством неметаллов, за исключением азота и йода.
1) при нагревании сера реагирует с водородом, образуя сероводород: S + Н2 = H2S;
2) взаимодействуя с металлами, сера образует сульфиды: S + Fe = FeS; 2Al + 3S = Al2S3;
3) при сжигании серы в струе кислорода образуется сернистый газ или сернистый ангидрид SO2: S + O2 = SO2;
4) чистая сера способна проявлять восстановительные свойства: S + 2HNO3 = H2SO4 + 2NO.
Сера используется в большом количестве в народном хозяйстве. Серу используют для получения резины – при помощи серы происходит ее затвердевание (вулканизация).
Каучук с высоким содержанием серы называется эбонит, являющийся качественным электрическим изолятором. Для уничтожения некоторых сельскохозяйственных вредителей серу применяют в виде серного цвета. Серу используют для приготовления спичек, синей краски (ультрамарина), сероуглерода, серной кислоты.
Сероводород и сульфиды.
Сероводород (H2S) – бесцветный газ с резким запахом гниющего белка. В природе встречается вводах минеральных ключей вулканических газах, гниении отбросов, а также при разложении белков погибших растений и животных.
Получение:
1) прямой синтез из элементов, при температуре 600 °C;
2) воздействием на сульфиды натрия и железа соляной кислотой.
Физические свойства: сероводород тяжелее воздуха, очень ядовит. Сжижение его происходит при -60,8 °C, затвердение – при -85,7 °C. Легко воспламеняется на воздухе. Растворим в воде – при температуре 20 °C в 1 литре воды можно растворить 2,5 литра сероводорода, при этом образуется сероводородная кислота.
Химические свойства: сероводород – сильный восстановитель, в зависимости от условий (температура, pH раствора, концентрация окислителя) при взаимодействии с окислителями он окисляется до диоксида серы или серной кислоты:
1) горит голубоватым пламенем на воздухе:

2) при высокой температуре разлагается:
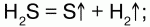
3) вступает в реакцию с галогенами:
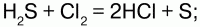
4) взаимодействует с окислителями:

5) серебро при взаимодействии с сероводородом темнеет:
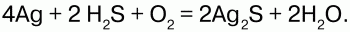
Применение: сероводород используют как химический реактив, а также как сырье для получения серы и серной кислоты.
Сероводородная кислота – слабая кислота. Водный раствор сероводорода.
Сульфиды – средние соли сероводородной кислоты.
Получение сульфидов:
1) взаимодействие металлов с серой при высокой температуре: Fe + S = FeS;
2) взаимодействие сводными растворами солей металлов: CuSO4 + H2S = CuS? + H2SO4;
3) сульфиды подвергаются гидролизу:
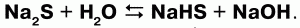
Взбалтывая раствор сульфида с серой можно обнаружить после выпаривания остаток, содержащий полисульфиды (многосернистые металлы).
Полисульфиды – соединения с большим содержанием серы, например Na2S2, Na2S5.
Для сульфидов характерны соединения переменного состава (FeS1,01—FeS1,14).
Природные сульфиды – основа руд цветных и редких металлов, поэтому их используют в металлургии. Некоторые сульфиды используют в производстве серной кислоты(FeS2 – железный колчедан). В химической и легкой промышленности применяют сульфиды щелочных и щелочноземельных металлов (в качестве основы люминофоров). В электронной технике используются как полупроводники.
БИЛЕТ №38
Оксиды серы, сернистая кислота и ее соли.
Окси́д се́ры(IV) (диокси́д се́ры, двуокись серы, серни́стый газ, серни́стый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой серни́стой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, се́рной кислоте. SO2 — один из основных компонентов вулканических газов.
Получение
· Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
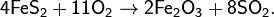
· В лабораторных условиях и в природе SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты. Образующаяся сернистая кислота H2SO3 сразу разлагается на SO2 и H2O:

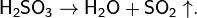
· Также диоксид серы можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
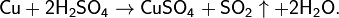
· Спектр поглощения SO2 в ультрафиолетовом диапазоне.
· Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
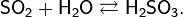
· Со щелочами образует сульфиты:
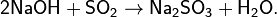
· Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
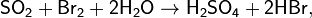
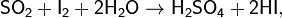
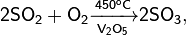
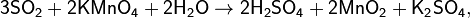
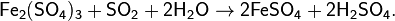
Предпоследняя реакция является качественной реакцией на сульфит-ион SO32− и на SO2 (обесцвечивание фиолетового раствора).
· В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы из отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II):
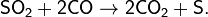
· Или для получения фосфорноватистой кислоты:
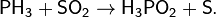
Применение
Большая часть оксида серы(IV) используется для производства сернистой кислоты. Используется также в виноделии в качестве консерванта (пищевая добавка E220). Так как этот газ убивает микроорганизмы, им окуривают овощехранилища и склады. Оксид серы(IV) используется для отбеливания соломы, шелка и шерсти, то есть материалов, которые нельзя отбеливать хлором. Применяется он также и в качестве растворителя в лабораториях. При таковом его применении следует помнить о возможном содержании в SO2 примесей в виде SO3, H2O, и как следствие присутствия воды H2SO4 и H2SO3. Их удаляют пропусканием через растворитель концентрированной H2SO4; это лучше делать под вакуумом или в другой закрытой аппаратуре[1]. Оксид серы(IV) применяется также для получения различных солей сернистой кислоты.
 2018-01-21
2018-01-21 8029
8029








