Ква́рцевое стекло́, пла́вленый кварц — однокомпонентное стекло из чистого оксида кремния, получаемое плавлением природных разновидностей кремнезёма — горного хрусталя, жильного кварца и кварцевого песка, а также синтетической двуокиси кремния.
· Обладает наименьшим среди стёкол на основе SiO2 показателем преломления (ne = 1,46008) и наибольшим светопропусканием, особенно для ультрафиолетовых лучей.
· Для кварцевого стекла характерна высокая термическая стойкость, коэффициент линейного термического расширения менее 1·10−6 К−1 (в диапазоне температур от 20 до 1400 °C).
· Кварцевое стекло — хороший диэлектрик, удельная электрическая проводимость при 20 °C — 10−14 — 10−16 Ом−1·м−1, тангенс угла диэлектрических потерь при температуре 20 °C и частоте 1016 Гц — 0,0025—0,0006.
Силикаге́ль представляет собой высушенный гель, образующийся из перенасыщенных растворов кремниевых кислот (nSiO2·mH2O) при pH > 5—6. Твёрдый гидрофильный сорбент.
Получается при подкислении растворов силикатов щелочных металлов с последующей промывкой и высушиванием образовавшегося геля:
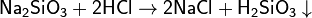

Силикаты (от лат. silex — камень) — соли кремниевых кислот: метакремниевой кислоты H2SiO3, например, Na2SiO3, ортокремниевой кислоты H4SiO4 и др. В природе встречается в виде минералов, а также являются основой горных пород, из которых состоит земная кора[1].
Кроме солей ортокремниевая кислота способна образовывать ортосиликаты-эфиры в общем случае имеющие вид R1R2R3R4SiO4, где R1-4 — органические радикалы, как правило, являющиеся спиртовыми остатками. Известным массовым продуктом является тетраэтилортосиликат состава Si(C2H5O)4
Физические свойства
Природные силикаты довольно тугоплавки (1000—1300 °С, иногда до 2000 °С и выше). Имеют относительно большую твёрдость: 6-8 баллов по шкале Мооса[1].
Химические свойства
Силикаты взаимодействуют со следующими веществами:
· С кислотами, даже с очень слабыми, например, с угольной:
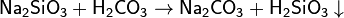
· С растворимыми солями:

· Гидролиз:
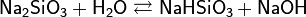
Цемент (лат. caementum — «щебень, битый камень») — искусственное неорганическое вяжущее вещество. Один из основных строительных материалов. При затворении водой, водными растворами солей и другими жидкостями образует пластичную массу, которая затем затвердевает и превращается в камневидное тело. В основном используется для изготовления бетона и строительных растворов. Цемент является гидравлическим вяжущим и обладает способностью набирать прочность во влажных условиях, чем принципиально отличается от некоторых других минеральных вяжущих — (гипса, воздушной извести), которые твердеют только на воздухе.
Бетон — искусственный каменный строительный материал, получаемый в результате формования и затвердевания рационально подобранной и уплотнённой смеси, состоящей из вяжущего вещества (цемент или др.), крупных и мелких заполнителей, воды. В ряде случаев может иметь в составе специальные добавки, а также не содержать воды (например, асфальтобетон).
Вопрос №50. Щелочные металлы. Общая характеристика элементов главной подгруппы I группы. Распространенность и нахождение в природе. Способы получения натрия и калия. Физические и химические свойства щелочных металлов.
Общая характеристика элементов главной подгруппы I группы.
Металлы главной подгруппы первой группы — литий, натрий, калий, рубидий, цезий и франций — называются щелочными металлами.
Во внешнем электронном слое атомы щелочных металлов имеют по одному электрону. Во втором электронном слое у атома лития содержатся два электрона, а у атомов остальных щелочных металлов — по восемь электронов.
Распространенность и нахождение в природе.
Вследствие очень легкой окисляемости щелочные металлы встречаются в природе исключительно в виде соединений. Натрий и калий принадлежат к распространенным элементам. Оба металла входят в состав различных минералов и горных пород силикатного типа. Хлорид натрия содержится в морской воде, а также образует мощные отложения каменной соли во многих местах земного шара. В верхних слоях этих отложений иногда содержатся довольно значительные количества калия, преимущественно в виде хлорида или двойных солей с натрием и магнием. Однако большие скопления солей калия, имеющие промышленное значение, встречаются редко. Наиболее важными из них являются соликамские месторождения в СССР, страссфуртские в Германии и эльзасские — во Франции. Залежи натриевой селитры находятся в Чили.
Получение и свойства щелочных металлов.
Натрий и литии получают электролизом расплавов их соединений, калий — восстановлением из расплавов КОН или КСl натрием, рубидий и цезий — восстановлением из их хлоридов кальцием.
Все щелочные металлы кристаллизуются в кубической объемно-центрированной решетке. Они обладают металлическим блеском, который можно наблюдать на свежем разрезе металла. На воздухе блестящая поверхность металла сейчас же тускнеет вследствие окисления.
Щелочные металлы характеризуются незначительной твердостью, малой плотностью и низкими температурами плавления и кипения. Наименьшую плотность имеет литий, самую низкую температуру плавления — франций.
Способы получения натрия и калия.
Металлический натрий получают электролизом расплава хлорида натрия, к которому для снижения температуры плавления добавляют хлорид кальция.
Гидроксид калия, или едкое кали, КОН получается аналогично гидроксиду натрия — электролизом раствора хлорида калия.
Физические и химические свойства щелочных металлов.
Калий и натрий – серебристо-белые металлы. Эти металлы очень мягкие, режутся ножом. Обладают всеми свойствами, присущими веществам с металлической связью, а именно: металлический блеск, пластичность, мягкость, хорошая электрическая проводимость и теплопроводность.
При химическом взаимодействии, атомы калия и натрия легко отдают валентные электроны, переходя в положительно заряженные ионы: K+ и Na+. Оба металла являются сильными восстановителями.
Быстро окисляются на открытом воздухе, поэтому необходимо хранить калий и натрий под слоем керосина.
Реакция с водой - бурная. Эти металлы легко взаимодействуют со многими неметаллами –серой, фосфором, галогенами и др.
 2018-01-21
2018-01-21 1490
1490








