Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами.
Для железа характерен полиморфизм, оно имеет четыре кристаллические модификации:
1)до 769 °C существует α-Fe (феррит) с объёмноцентрированной кубической решёткой и свойствами ферромагнетика (769 °C ≈ 1043 K — точка Кюри для железа);
2)в температурном интервале 769—917 °C существует β-Fe, который отличается от α-Fe только параметрами объёмноцентрированной кубической решётки и магнитными свойствами парамагнетика;
3)в температурном интервале 917—1394 °C существует γ-Fe (аустенит) с гранецентрированной кубической решёткой;
4)выше 1394 °C устойчиво δ-Fe с объёмноцентрированной кубической решёткой.
Железо относится к умеренно тугоплавким металлам. В ряду стандартных электродных потенциалов железо стоит до водорода и легко реагирует с разбавленными кислотами. Таким образом, железо относится к металлам средней активности.
|
|
|
Температура плавления железа 1539 °C, температура кипения — 2862 °C.
Взаимодействует с кислотами:
· С соляной кислотой:
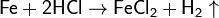
· С разбавленной серной кислотой:
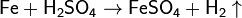
· Взаимодействие с кислородом:
· Железо горит в кислороде, нагретое горит на воздухе, пирофорное — на воздухе без нагревания:
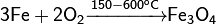
· Взаимодействие с порошком серы при нагревании:
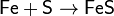
· Взаимодействие с галогенами при нагревании:
· Горение в хлоре: 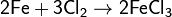
 2018-01-21
2018-01-21 439
439







