ЭЛЕКТРОЛИЗ - совокупность процессов электрохимического окисления — восстановления, происходящих на погруженных в электролит электродах при прохождении электрического тока.
КI – расплав: KI – раствор:
КI 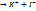 КI
КI 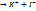
HOH 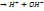
K(-): 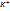 +1e=
+1e= 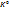 K(-): (
K(-): ( ): 2
): 2 
A(+):  -2e =
-2e = 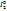 A(+): (
A(+): ( ):
):  =
= 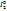
Суммарный процесс:
2 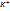 +2
+2  2
2 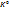 +
+ 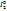 2
2 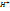 + 2
+ 2  +
+ 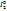
2KI  2
2 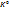 +
+ 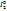 2KI + 2HOH
2KI + 2HOH 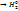 +
+ 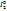 + 2KOH
+ 2KOH
Стандартный электродный потенциал, его физический смысл.
Стандартный электродный потенциал – величина, характеризующая химическую активность металла, т.е. это разность потенциалов между Ме опущенным в раствор его соли с концентрацией 1 моль/л и стандартным водородным электродом при р=101,3 кПа и Т=298К.
 2018-01-21
2018-01-21 582
582








