D. Заряд внутренней сферы комплексного иона.
E. Заряд комплексообразователя металла-антидота
5. В какой области рН должен лежать интервал изменения окраски индикатора при титровании слабого основания сильной кислотой?
A. щелочной;
B. кислотной;
C. нейтральной;
D. рН= 7;
E. рН > 7
6.Укажите формулу для определения молярной массы эквивалента вещества:
A. Мэ = f . М(х).
B. Мэ = V . C;
C. Мэ = С . w;
D. Мэ = f . V . C;
E. Мэ = f . М(х) . C
7.Указать формулу соли с кислой реакцией среды:
A. Na2SO4
B. KCl
C. K2S
D. (NH4)2 SO4
E. Na2CO3
8.Как рассчитать рН в растворе КОН?
A. рН = 14 -lgCосн.a
B. рН = - lg[H+]
C. рН = -lgCосн.a
D. рН = - lg[ОH-]
E.pH = 14 + lgCосн.
9. Укажите, каким раствором титруют в методе нейтрализации, который называется ацидиметрией:
A.раствором сильной кислоты;
B. раствором щелочи;
C. раствором основания;
D. раствором соли, образованной слабой кислотой;
E.комплексоном
10. Из приведенных смесей выберите ту, что обладает буферным действием:
A. CH3COOH + CH3COONH4.
B. HCl + NH4Cl.
C. CH3COOH + CH3COONа.
D. HNO3 + NaNO3.
E. NaOH + NaCl.
11. Укажите химическую реакцию, которая происходит при прибавлении к ацетатному буферу небольшого количества щелочи:
A. 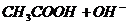
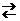
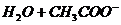
B. 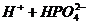
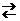
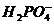
C. 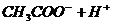
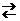
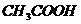
D. 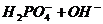
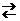
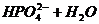
12.Как записывается уравнение Гендерсона-Хассельбалха для кислотного буфера?
A. 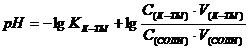
B. 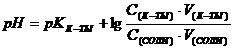
C. 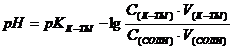
D. 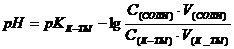
13. При каком соотношении количеств вещества кислоты и соли в ацетатном буфере ёмкость имеет максимальное значение:
A. 90/10;
B. 50/50;
C. 5/15;
D. 75/25;
E. 94/6.
14. Ацетатные буферные системы состоят из 100 мл раствора кислоты и 100 мл раствора соли, взятых в следующих концентрациях:
 2018-01-21
2018-01-21 143
143







