| гальванические элементы | первичные ХИТ | из-за необратимости протекающих в них реакций невозможно перезарядить |
| электрические аккумуляторы | вторичные ХИТ | перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить |
| топливные элементы | электрохимические генераторы | устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно |
| Преимущества | Недостатки |
| Гальванические элементы как источники электрической энергии обладают существенными преимуществами: они могут быть различных размеров и форм, не имеют макроскопически подвижных, подверженных износу частей, относительно легки и автономны, мало чувствительны к вибрации и колебаниям температуры, работают бесшумно, хорошо регулируются. Их КПД довольно высок (до 90%), так как превращение химической энергии в электрическую совершается в них без промежуточной тепловой стадии, а электродные процессы в некоторых случаях близки к обратимым. | Существенным недостатком гальванических элементов является саморазряд - расходование ими электрохимически активных веществ при отсутствии внешнего тока. |
Возникновение скачка потенциала на границе металл-электролит:

Равновесный электродный потенциал, его зависимость от концентрации (уравнение Нернста):
Равновесным электродным потенциалом называется разность потенциалов между электродом - и раствором при установившемся динамическом равновесии. Зависимость равновесных электродных потенциалов от концентрации их собственных ионов в растворе выражается формулой Нернста.
Уравнение Нернста:
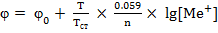
или упрощенная приближенная формула
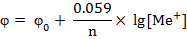
Устройство гальванических элементов:
Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока.
Процессы, происходящие на электродах элемента:
Все электрохимические реакции происходят при протекании электрического тока в цепи. Непрерывность протекания тока в цепи обеспечивается только тогда, когда происходят процессы на электродах, т.е. на границе металл ‒ электролит.
Электродные процессы– процессы, связанные с переносом зарядов через границу между электродом и раствором.
Катодные процессы связаны с восстановлением молекул или ионов реагирующего вещества, анодные – с окислением реагирующего вещества и с растворением металла электрода.
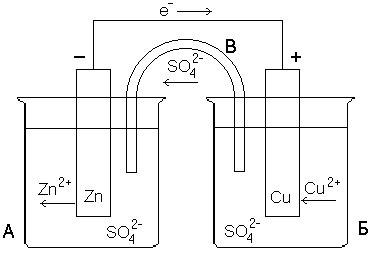
Электрохимические схемы гальванических элементов:
На рисунке показана схема гальванического элемента, т.е. установки, делающей возможной такую передачу электронов по проводу. В гальваническом элементе происходит непосредственное преобразование энергии химической реакции в электрическую энергию.
Определение стандартных электродных потенциалов:
Чтобы определить стандартный электродный потенциал металла, измеряют ЭДС гальванического элемента, один из электродов которого – исследуемый металл, погруженный в раствор его соли (при концентрации 1 моль/л), а второй электрод – эталонный (его еще называют водородным).
Таким образом, все электродные потенциалы – не абсолютные, а относительные, измеренные для гальванической пары металл – водород (потенциал стандартного водородного электрода принимают равным нулю). Измеренные в таких условиях потенциалы различных металлов всегда будут постоянными, они занесены во все справочники и приводятся обычно для температуры 25  ). Электродные потенциалы самых активных металлов, реагирующих с водой, получены косвенным путем.
). Электродные потенциалы самых активных металлов, реагирующих с водой, получены косвенным путем.
Типы гальванических элементов:
1) Гальванические первичные элементы - это устройства для прямого преобразования химической энергии, заключенных в них реагентов (окислителя и восстановителя), в электрическую.
2) Вторичные источники тока (аккумуляторы) - это устройства, в которых электрическая энергия внешнего источника тока превращается в химическую энергию и накапливается, а химическая – снова превращается в электрическую.
3) Электрохимические генераторы (топливные элементы) - это элементы, в которых происходит превращение химической энергии в электрическую.
Стандартный водородный электрод:
Стандартный водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах.
Электрохимический ряд напряжений:
Электрохимический ряд напряжений - последовательность расположения электродов в порядке возрастания их стандартных электродных потенциалов.
Электрохимический ряд напряжений позволяет судить о термодинамической возможности протекания тех или иных электродных процессов.
Металлические электроды в водном растворе электролита образуют следующий электрохимический ряд напряжений:
Li, К, Rb, Ba, Sr, Ca, Na, Се, Mg, Be, Al, Ti, Mn, V, Zn, Cr, Ga, Fe, Cd, In, Tl, Co, Ni, Sn, Pb, H2, Bi, Cu, Hg, Ag, Pt, O2, Au.
Явление поляризации:
При смещении потенциала электрода в положительную или в отрицательную сторону на нем начинают протекать процессы окисления или восстановления. Отклонение потенциала электрода от его равновесного значения называется электрохимической поляризацией или просто поляризацией.
Поляризация препятствует протеканию тока.
Деполяризация:
Деполяризация — снижение или устранение поляризации электродов при работе химических источников тока и при электролизе под влиянием деполяризаторов — веществ, вводимых в электролит или в состав электродов. В качестве деполяризаторов катода используются окислители, анода — восстановители. Деполяризаторы либо сами участвуют в электродном процессе, либо увеличивают скорость процесса и тем самым снижают поляризацию электрода.
БИЛЕТ
Электрохимическая коррозия — это процесс взаимодействия металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала.
Ее виды и механизм протекания:
К электрохимической коррозии относятся такие виды местных разрушений, как
· питтинги,
· щелевая.
Механизм электрохимической коррозии связан с возникновением и работой на поверхности металла во влажной среде микрогальванических элементов. Коррозия осуществляется в результате осуществления анодного (коррозионное окисление металла) и катодного (восстановление окислителя, находящегося во влажной среде) процессов. Процессы окисления и восстановления разделены в пространстве и не мешают друг другу. Кроме природы металла, окислителя и содержания последнего на скорость коррозии влияет природа и количество различных примесей, содержащиеся как в самом металле, так и коррозионной среде - в атмосфере или в растворе.
Факторы, влияющие на скорость протекания электрохимической коррозии:
| ВНУТРЕННИЕ | ВНЕШНИЕ |
| · электрохимическая активность металлов · наличие примесей · состояние поверхности · структура | · состав коррозионной среды · pH среды · температура · дифференциальная аэрация |
Причины ее возникновения:
Причиной электрохимической коррозии является возникновение на поверхности металла короткозамкнутых гальванических элементов. В тонком слое влаги, обычно покрывающем металл, растворяются кислород, углекислый, сернистый и другие газы, присутствующие в атмосферном воздухе. Это создает условия соприкосновения металла с электролитом. Различные участки поверхности любого металла обладают разными потенциалами. Причинами этого могут быть наличие примесей в металле, различная обработка отдельных его участков, неодинаковые условия (окружающая среда), в которых находятся различные участки поверхности металла. При этом участки поверхности металла с более электроотрицательным потенциалом становятся анодами и растворяются.
Перенапряжение и его роль при коррозии металлов:
Перенапряжение данного электродного процесса – величина поляризации, необходимая для протекания данного электродного процесса с определенной скоростью.
Таким образом, перенапряжение выделения водорода на различных металлах различно.
Перенапряжение зависит от температуры, природы электродного материала и состава раствора. Перенапряжение необходимо для ускорения нужной электродной реакции. Если скорость электродной реакции в целом определяется скоростью собственно электрохимической стадии, связанной с переносом заряда, то перенапряжение усиливает электрическое поле, действующее на разряжающиеся частицы, благодаря чему снижается энергия активации разряда. Поскольку электрическое поле в значительной степени обусловлено строением двойного электрического слоя, перенапряжение оказывается зависящим от концентрации постороннего электролита и адсорбирующихся веществ, влияющих на распределение потенциала в двойном слое. На повышении перенапряжения основано действие многих ингибиторов коррозии металлов, что является одной из положительных сторон перенапряжения. В то же время перенапряжение в промышленном электролизе, неизбежно связанное с дополнительным расходом энергии, приводит к увеличению себестоимости продукции.
Методика расчета возможности коррозии металлов и их сплавов в конкретных условиях:
1) Определить катод и анод (при условии, что 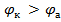 )
)
2) Написать реакцию на аноде.
3) Написать реакцию на катоде: деполяризация.
4) Рассчитать возможность возникновения коррозии для каждого деполяризатора отдельно:
Если  , то коррозия с данным деполяризатором возможна.
, то коррозия с данным деполяризатором возможна.
 2018-01-21
2018-01-21 3429
3429







