Существуют различные случая аналогии.
Полные электронные аналоги – элементы одной подгруппы, которые имеют однотипные структуры электронных оболочек.
F, Cl, Br, I Zn, Cd,Hg
F 2s2 2p5 Zn 4s2 3d10
Cl 3s2 3p5 Cd 5s2 4d10
Br 4s2 3d10 4p5 Hg 6s2 4f14 5d10
I 5s2 4d10 5p5
Неполные электронные аналоги – элементы одной группы, но разных подгрупп, принадлежат к разным электронным семействам. Общее число валентных электронов одинаково, что и объединяет их в одну группу.
Cl Mn
… 3s2 3p5 …4s2 3d5
Потенциал ионизации, сродство к электрону, электроотрицательность:
Потенциал ионизации – энергия, необходимая для отрыва от атома наиболее слабо связанного электрона: 
Наименьшие потенциалы ионизации у щелочных металлов, наибольшие – у инертных газов.
Сродство к электрону – энергия, которая выделяется при присоединение электрона к атому:  .
.
Наибольшее сродство к электрону у галогенов, наименьшее (иногда отрицательное) у металлов.
Электроотрицательность – способность атома притягивать к себе электронную пару химической связи.
Чем более типичным металлом является элемент, тем ниже его ЭО; чем более типичным неметаллом является элемент, тем выше его ЭО
Закономерности в изменениях этих величин в группах и периодах:
ЭО закономерно изменяется в зависимости от положения элемента в периодической системе. В начале каждого периода находятся элементы с наиболее низкой ЭО – типичные металлы, в конце периода (перед благородными газами) - элементы с наивысшей ЭО, т.е. типичные неметаллы. У элементов одной и той же подгруппы ЭО с ростом числа электронных оболочек проявляет тенденцию к уменьшению.
Энергия ионизации и сродство к электрону зависят от радиуса атома и поэтому характер их изменения по периодам и подгруппам близок к характеру изменения радиуса. Т.е. в группах энергия ионизации и сродство электронов увеличиваются, а в периодах – уменьшаются.
БИЛЕТ
Энергетика химических процессов:
Энергетика химических процессов – часть химической термодинамики. Энергетическое состояние химической реакции как системы описывается с использованием следующих характеристик:
U – внутренняя энергия
H – энтальпия
S – энтропия
G – энергия Гиббса
I закон термодинамики – это закон сохранения энергии:
Изменение внутренней энергии не зависит от способа проведения процесса, а определяется только начальным и конечным состоянием системы.

Первый закон термодинамики – количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Внутренняя энергия и энтальпия:
Внутренняя энергия – такая форма энергии, скрытая в веществах и частично освобождающаяся при химических, а также при некоторых физических процессах.
Внутренняя энергия (U) вещества (или системы) складывается из кинетической энергии движения ядер, электронов, молекул и потенциальной энергии взаимодействия этих частиц.
 , где
, где 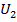 - общая энергия продуктов реакции;
- общая энергия продуктов реакции;  – общая энергия исходных веществ.
– общая энергия исходных веществ.
Энтальпия (H) – энергия, которая выделяется при образовании одного моль сложного вещества из простых веществ.
Энтальпия рассчитывается как относительная величина:

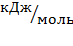


Тепловой эффект любой реакции зависит от температуры. Если температура не указана, то по умолчанию ее считают равной 25 
Подобно внутренней энергии, энтальпия определяется состоянием системы и не зависит от того, каким путем достигнуто.
Закон Гесса, следствие из него:
Энергия, которая выделяется в ходе реакции, зависит только от начального и конечного состояния, но не зависит от пути.
Следствие: тепловой эффект химической реакции равен сумме энтальпий образования получающихся веществ за вычетом суммы энтальпий образования исходных веществ (с учетом стехиометрических коэффициентов).
Термохимические уравнения и расчеты:
В изолированных системах энтропия самопроизвольно протекающего процесса возрастает.

Энтропия, ее изменение в химических процессах:
Энтропия (S) – мера беспорядка, тепловое и механическое напряжение системы.
Энтропия является абсолютной величиной. Рассчитывается не только экспериментально, но и теоретически:
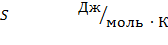
 , где или
, где или  , где
, где
k – постоянная Больцмана; R –газовая постоянная;
W – общее число всех возможных 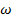 - число состояний, которые
- число состояний, которые
состояний системы. принимает одна молекула или
одна ячейка кристалл. решетки.
Во всех процессах, сопровождающихся хаотизацией структуры системы – плавление кристаллов, испарение жидкостей, расширение газов, смещение и растворение, химические реакции разложения происходит увеличение энтропии.
В обратных им процессах – кристаллизации, конденсации паров, сжатии газов, где порядок расположения элементов системы возрастает, происходит уменьшение энтропии.
Энергия Гиббса:
Энергия Гиббса – работа, которую совершает система при постоянном давлении:

Отрицательное значение  той или иной реакции указывает именно только на возможность ее протекания.
той или иной реакции указывает именно только на возможность ее протекания.
Направленность химических процессов:
БИЛЕТ.
Понятие о механизме химической реакции:
Механизм химической реакции – совокуп6ность элементарных реакций, из которых складывается сложная химическая реакция. При изучении элементарных реакций под механизмом реакции также понимают вид и характер взаимодействия молекул и ионов, их взаимную ориентацию и энергию, тип переходного состояния.
Гомогенные и гетерогенные системы:
Гомогенная система - однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков
Гетерогенная система - неоднородная система, состоящая из однородных частей (фаз), разделенных поверхностью раздела. Однородные части (фазы) могут отличаться друг от друга по составу и свойствам.
Условия протекания реакций:
Понятие о скорости химической реакции:
· Скорость химической реакции – число элементарных актов реакции, происходящих в единицу времени, в единице объема или на единице поверхности раздела фаз.
· Скорость химической реакции – скорость изменения количества вещества в процессе химической реакции в единице объема.
Средняя скорость и скорость истинная:
Средняя скорость - скорость за какой-либо определенный промежуток времени:
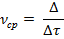
P.S.: 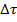 - бесконечно малый промежуток времени.
- бесконечно малый промежуток времени.
Истинная скорость – скорость в данный конкретный момент времени:
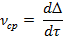
Зависимость скорости химической реакций от концентрации (закон действующих масс) для гомогенных и гетерогенных реакций:
Константа скорости реакции, ее физический смысл, и размерность:
Константа скорости реакции - является коэффициентом пропорциональности в кинетическом уравнении. Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от значения концентраций реагентов.
Физический смысл константы скорости заключается в том, что она равна скорости реакции при единичных концентрациях реагирующих веществ.
Размерность константы скорости реакции не зависит от выбора единиц измерения концентрации а и зависит только от принятых единиц времени.
Для реакции 1-го порядка размерность константы скорости [  ] и, в зависимости от природы реагирующих веществ, она измеряется в обратных секундах, минутах, часах и т.д.
] и, в зависимости от природы реагирующих веществ, она измеряется в обратных секундах, минутах, часах и т.д.
Размерность константы скорости k2 – [  ].
].
Порядок и молекулярность реакции:
Молекулярность реакции - число молекул, участвующих в элементарном акте химического взаимодействия. По числу молекул, принимающих участие в элементарном акте химического превращения, различают реакции моно (одно), би (2) тримолекулярные реакции. Вероятность соударения одновременно большего числа частиц очень мала; поэтому тримолекулярные реакции очень редки, а 4х неизвестны.
Порядок реакции - сумма показателей степеней в кинетических уравнениях. Порядок реакции определяет характер зависимости скорости от концентрации.
Зависимость скорости реакции от температуры (правило Вант-Гоффа):
Правило Вант-Гоффа:
При нагревании на 10  скорость большинства химических реакций увеличивается в 2-4 раза.
скорость большинства химических реакций увеличивается в 2-4 раза.
Математически это означает что, что скорость реакции является степенной функцией от температуры:
 , где a =
, где a = 
Уравнение Аррениуса описывает температурную зависимость константы скорости.
 , где
, где
A – предэкспоненциальныи множитель, который определяется только видом реакции,
 – энергия активации,
– энергия активации,
Т – абсолютная температура,
k – постоянная Больцмана.
БИЛЕТ
Обратимые химические реакции:
Обратимые химические реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Обратимая реакция может протекать как в прямом, так и в обратном направлениях.
Химическое равновесие – такое состояние химической системы, при котором с течением времени не происходит изменения концентраций веществ. При равновесии протекают и прямая, и обратная реакции, их скорости одинаковы, вследствие чего изменений в системе не заметно.
Константа равновесия для гомогенных и гетерогенных реакций, ее физический смысл:
Константа равновесия любой гомогенной химической реакции, протекающей в газовой фазе, равна произведению равновесных парциальных давлений продуктов реакции, делённому на произведение равновесных парциальных давлений исходных веществ, в степенях, соответствующих стехиометрическим коэффициентам участников реакции.
Константа равновесия любой гетерогенной химической реакции выражается точно так, же как и константа равновесия гомогенной химической реакции, только в уравнение константы не входят парциальные давления участников реакции, находящихся в конденсированных фазах: жидких или твёрдых.
Смещение химического равновесия (принцип Ле-Шателье):
Принцип Ле-Шетелье:
Если на систему, которая находится в состоянии динамического равновесия, подействовать извне, то внутри системы преимущество получают те процессы, которые противоположны внешнему воздействию.
| Внешняя среда | Система |
| С увеличивается | С уменьшается |
| Р увеличивается | Р уменьшается |
| Т увеличивается | Т уменьшается |
1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении экзотермической реакции.
2. Влияние давления. При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом;
при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом
3. Влияние концентрации. При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Связь энергии Гиббса и константы равновесия:
Константа равновесия связана со стандартной энергией Гиббса следующим соотношением:

БИЛЕТ
Понятие о дисперсных системах:
Дисперсные системы – гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого.
То вещество, которое распределено в объеме другого, называют дисперсной фазой. Второе вещество носит название дисперсионной среды.
Классификация дисперсных систем:
| Дисперсионная среда | Дисперсная фаза | Название дисперсной системы | Примеры дисперсных систем |
| Газ | Жидкость | Аэрозоль | Туман,облака, карбюраторная смесь бензина с воздухом в двигателе автомобиля. |
| Твердое вещество | Аэрозоль | Дым, смог, пыль в воздухе | |
| Жидкость | Газ | Пена | Газированные напитки, взбитые сливки |
| Жидкость | Эмульсии | Молоко, майонез, жидкие среды организма (плазма крови, лимфа), жидкое содержимое клеток (цитоплазма, кариоплазма) | |
| Твердое вещество | Золь, суспензия | Речной и морской ил, строительные растворы, пасты. | |
| Твердое вещество | Газ | Твердая пена | Керамика, пенопласты, полиуретан, поролон, пористый шоколад. |
| Жидкость | Гель | Желе, желатин, косметические и медицинские средства (мази, тушь, помада) | |
| Твердое вещество | Твердый золь | Горные породы, цветные стекла, некоторые сплавы. |
Растворы, их виды:
Раствор – однородная система переменного состава, содержащая два или большее число веществ.
1. По агрегатному состоянию
1.1. Твердые
1.2. Жидкие
1.3. Газообразные
2. По содержанию растворенного вещества
2.1. Разбавленные
2.2. Концентрированные
3. По степени насыщенности
3.1. Насыщенный раствор
3.2. Ненасыщенный раствор
Способы выражения концентрации растворов:
Массовая концентрация (  ) – отношение массы вещества (
) – отношение массы вещества ( ) к массе раствора (m).
) к массе раствора (m).

Молярная концентрация ( 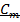 ) – число моль растворенного вещества в единице объема раствора.
) – число моль растворенного вещества в единице объема раствора.
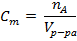
Нормальная концентрация (  ) – число моль эквивалентов на единицу объема раствора.
) – число моль эквивалентов на единицу объема раствора.

Моляльная концентрация ( 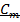 ) – число моль растворенного вещества на 1000г. растворителя.
) – число моль растворенного вещества на 1000г. растворителя.
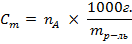
Растворимость:
Растворимость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
Растворимость зависит от природы растворяемого вещества и растворителя, температуры и давления.
Свойства растворов неэлектролитов: давление растворителя, температуры кипения, замерзания, осмотическое давление (законы Рауля и Вант-Гоффа):
1) Давление пара над чистым растворителем всегда больше, чем давление пара над раствором.
 ,
, 

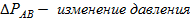

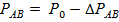

2) Температура замерзания растворов всегда ниже температуры замерзания чистого растворителя.

3) Температура кипения раствора всегда выше температуры кипения чистого растворителя

4) Осмотическое давление – давление молекул растворителя на полупроницаемую перегородку, которая разделяет 2 раствора. Полупроницаемая перегородка – мембрана, через которую могут переходить только молекулы растворителя, но не могут молекулы и ионы растворенного вещества. Таким образом, число частиц в 1-м растворе увеличивается, а во 2-м уменьшается. Эта разница преобразует давление, которое называется осмотическим.

БИЛЕТ
Отклонение свойств электролитов от свойств растворов неэлектролитов:
Изотонический коэффициент:
Изотонический коэффициент (i), введенный Вант-Гоффом, показывает, во сколько раз осмотическое давление данного раствора больше «нормального».
Изотонический коэфициент показывает, во сколько раз сумма числа ионов и недиссоциированных молекул электролита в растворе больше числа молекул электролита, взятых для растворения. В то же время оно показывает, во сколько раз возрастает повышение температуры кипения раствора или понижение температуры замерзания его при наличии диссоциации электролита при растворении, так как молекулы и ионы в растворе оказывают одинаковое влияние на упругость пара растворителя, а следовательно, и на его точку кипения и замерзания.

Электролитическая диссоциация, ее механизм:
Электролитическая диссоциация – распад некоторых веществ на ионы в растворе под действием молекул растворителя или в расплаве. Вещества, распадающиеся на ионы, называют электролитами. Электролиты – вещества с ионной или сильно полярной ковалентной связью кислоты, основания, соли. Остальные вещества – неэлектролиты; к ним относятся вещества с неполярной или слабо полярной ковалентной связью.
Механизм:
· Легче всего диссоциируют вещества с ионной связью. Как известно, эти вещества состоят из ионов. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. При этом образуются гидратированные ионы, т.е. ионы, химически связанные с молекулами воды.
· Аналогично диссоциируют и электролиты, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества также ориентируются диполи воды, которые своими отрицательными полюсами притягиваются к положительному полюсу молекулы, а положительными полюсами к отрицательному полюсу. В результате этого взаимодействия связующее электронное облако (электронная пара) полностью смещается к атому с большей электроотрицательностью, полярная молекула превращается в ионную и затем легко образуются гидратированные ионы.
Сильный электролит – вещество, степень диссоциации которого больше 30%. К сильным электролитам относят:
А) практические все соли – как растворимые, так и плохо растворимые;
Б) сильные кислоты – HCl, HBr, HJ, H2SO4, HNO3;
B) сильные основания (щелочи) – LiOH, NaOH, KOH, Ca(OH)2.
Слабый электролит – вещество, степень диссоциации которого меньше 3%. К слабым электролитам относят:
А) соли HgCl2, Fe(CNS)3;
Б) слабые кислоты – H2S, H2SO4, H2CO3, H2SiO3;
В) слабые основания – нерастворимые гидроксиды металлов и гидрат аммиака NH3  H2O
H2O
Степень и константа диссоциации:
Степень диссоциации  – отношение числа молекул, распавшихся на ионы N' к общему числу растворенных молекул N:
– отношение числа молекул, распавшихся на ионы N' к общему числу растворенных молекул N:

Степень диссоциации может изменять от 0 (диссоциации нет) до 1 (полная диссоциация).
Константа диссоциации – константа равновесия электролитической диссоциации. Она равна отношению произведений концентраций ионов, образующихся при диссоциации, к концентрации исходных частиц.
Для электролита YZ, диссоциирующего по уравнению

константа диссоциации равна:

Реакции в растворах электролитов:
Ионные реакции в растворах – реакции между ионами в растворах электролитов. В связи с принципом Ле-Шателье, все реакции идут в сторону уменьшения общего числа ионов в растворе. Это число может уменьшаться в следующих случаях.
1) При выпадении осадка
2) При выделении газа
3) При образовании слабого электролита – воды, слабой кислоты или комплексного соединения.
Реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
Следовательно, реакции идут с образованием веществ с меньшей концентрацией ионов в растворе в соответствии с законом действующих масс. Скорость прямой реакции пропорциональна произведению концентраций ионов реагирующих компонентов, а скорость обратной реакции пропорциональна произведению концентраций ионов продуктов. Но при образовании газов, осадков и слабых электролитов ионы связываются (уходят из раствора) и скорость обратной реакции уменьшается.
Ионные уравнения реакций:
Поскольку электролиты в растворах образуют ионы, то для отражения сущности реакций часто используют так называемые ионные уравнения реакций. Написанием ионных уравнений подчеркивается тот факт, что, согласно теории диссоциации, в растворах происходят реакции не между молекулами, а между ионами.
С точки зрения теории диссоциации при реакциях между ионами в растворах электролитов возможны два исхода:
1. Образующиеся вещества — сильные электролиты, хорошо растворимые в воде и полностью диссоциирующие на ионы.
2. Одно (или несколько) из образующихся веществ — газ, осадок или слабый электролит (хорошо растворимый в воде).
Произведение растворимости – константа диссоциации малорастворимых веществ в насыщенном растворе. Для вещества, диссоциирующего по уравнению

произведение растворимости имеет вид:

Если произведение концентраций ионов в растворе превышает ПР, то из раствора выпадает осадок. Если это произведение меньше ПР, то осадок не выпадает.
Условие выпадения осадка:
Произведение концентраций соответствующих ионов в степенях стехиометрических коэффициентов больше, чем произведение растворимости соли при данной температуре.

Получается пересыщенный раствор. Который, в отличие от ненасыщенного и насыщенного растворов, долго не существует и со временем превращается в насыщенный раствор и осадок.
БИЛЕТ
Диссоциация воды:
Вода – слабый электролит


Для очень слабых электролитов часто используют не саму константу диссоциации, а константу вещества, равную произведению константы диссоциации на концентрацию.


 ;
;  Ê
Ê  ;
;


Константа воды  . Эту константу для воды называют ионным произведением воды. Ионное произведение воды зависит только от температуры; при повышении температуры оно увеличивается.
. Эту константу для воды называют ионным произведением воды. Ионное произведение воды зависит только от температуры; при повышении температуры оно увеличивается.
При диссоциации воды на каждый ион  образуется один ион
образуется один ион  , следовательно, в чистой воде концентрации этих ионов должны быть одинаковы:
, следовательно, в чистой воде концентрации этих ионов должны быть одинаковы:  . Используя значение ионного произведения воды, находим:
. Используя значение ионного произведения воды, находим:

Такова концентрация ионов  и
и  в чистой воде. Рассмотрим, как изменится концентрация при добавлении других веществ, например соляной кислоты. Соляная кислота — сильный электролит, диссоциирующий в воде на ионы
в чистой воде. Рассмотрим, как изменится концентрация при добавлении других веществ, например соляной кислоты. Соляная кислота — сильный электролит, диссоциирующий в воде на ионы  и
и  . Следовательно, концентрация ионов
. Следовательно, концентрация ионов  в растворе будет увеличиваться. Однако ионное произведение воды от концентрации не зависит, поэтому при увеличении
в растворе будет увеличиваться. Однако ионное произведение воды от концентрации не зависит, поэтому при увеличении  должна уменьшаться
должна уменьшаться  .
.
Напротив, если к воде добавить щелочь, то концентрация  увеличится, а
увеличится, а  уменьшится. Таким образом, концентрации
уменьшится. Таким образом, концентрации  и
и  взаимосвязаны: чем больше одна величина, тем меньше другая, и наоборот.
взаимосвязаны: чем больше одна величина, тем меньше другая, и наоборот.
Кислотность растворов обычно выражают через концентрацию ионов  . В кислых растворах
. В кислых растворах  >10-7 моль/л, в нейтральных
>10-7 моль/л, в нейтральных  = 10-7 моль/л, в щелочных
= 10-7 моль/л, в щелочных  < 10-7 моль/л.
< 10-7 моль/л.
Характеристика кислотности и щелочности среды:
Водородный показатель, его значение в различных средах:
Для характеристики кислотности среды вместо концентрации 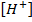 используют ее отрицательный десятичный логарифм – водородный показатель pH
используют ее отрицательный десятичный логарифм – водородный показатель pH

pH  7 7 | кислая среда |
pH 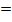 7 7 | нейтральная среда |
pH  7 7 | щелочная среда |
Индикаторы:
Для измерения pH существуют различные методы. Приближенно реакцию раствора можно определить с помощью специальных реактивов, называемых индикаторами, окраска которых меняется в зависимости от концентрации ионов водорода. Наиболее распространенные индикаторы – метиловый оранжевый, метиловый красный, фенолфталеин, лакмус.
| Индикатор | Окраска/кислая форма | Окраска/щелочная форма | |
| Фенолфталеин | бесцветный | красный | |
| Лакмус | красный | синий | |
| Метиловый красный | красный | желтый | |
| Метиловый оранжевый | розовый, желтый | желтый |
БИЛЕТ
Гидролиз солей:
Гидролиз солей – реакция взаимодействия с молекулами воды ионов, которые образуются при диссоциации солей.
Признаком гидролиза соли является изменение нейтральной реакции среды водного раствора.
Типичные случаи гидролиза (4 случая):
| Гидролиз I типа: | гидролиз по катиону (в реакцию с водой вступает только катион) |
| Гидролиз II типа: | гидролиз по аниону (в реакцию с водой вступает только анион) |
| Гидролиз III типа: | совместный гидролиз (в реакцию с водой вступает и катион, и анион) |
| Гидролиз IV типа: | гидролиз не идет |
Совместный гидролиз (в реакцию с водой вступает и катион и анион)
Соль, образованная слабым основанием и слабой кислотой, гидролизуется и по катиону, и по аниону. В результате образуются малодиссоциирующие основание и кислота. рН приблизительно равен 7, следовательно среда нейтральная.
Количественные характеристики гидролиза: степень гидролиза, константа гидролиза:
Количественные характеристики определяются только для I и II типа. К количественным характеристикам относится константа гидролиза ( ), степень гидролиза (
), степень гидролиза ( ).
).
Степень гидролиза – отношение числа молекул, подвергшихся гидролизу, к общему числу растворенных молекул.
Константа гидролиза - отношение произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов
| Гидролиз по аниону: | Гидролиз по катиону | |
| Константа гидролиза: |  |  |
| Степень гидролиза: |  |  |
12 БИЛЕТ
Валентность и степень окисления:
Валентность – число химических связей, образованных данным атомом в соединении. Под числом химических связей подразумевается число общих пар электронов.
Понятие «валентность» применимо только к соединениям с ковалентными связями или к молекулам в газовой фазе.
Степень окисления – условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер, т.е. электронные пары смещены к более электроотрицательным атомам. — Вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций
Степень окисления – число электронов, смещенных от атома (иона) данного элемента или к атому (иону) данного элемента в соединении.
Степень окисления может быть положительной (электроны смещены от атома или иона) и отрицательной (электроны смещены к атому или иону).
Определение степени окисления атомов различных элементов:
- Степень окисления элемента в простом веществе равна нулю;
- Степень окисления металлов всегда положительна. Степень окисления металлов главных подгрупп как правило, равна номеру группы. Степень окисления металлов побочных групп может принимать несколько значений;
- Степени неметаллов могут быть как положительными, так и отрицательными, в зависимости от того с каким атомом он соединён: если с атомом металла то всегда отрицательная, если с неметаллом-то может быть и (+), и (-). Высшую отрицательную степень окисления неметаллов можно найти, вычтя из 8 номер группы, в которой находится данный элемент, высшая положительная равна числу электронов на внешнем слое.
- Алгебраическая сумма степеней окисления атомов в молекуле (ионе) равна нулю (заряду иона).
Процессы окисления и восстановления:
Окисление и восстановление — два процесса, происходящие при химических реакциях определенного типа.
Окисление – процесс отдачи электронов.
Окисляясь, вещество либо соединяется с кислородом, либо теряет водород, либо теряет электроны. Окисление происходит при горении древесины и газа, взрывах, сгорании топлива.
Восстановление –это процесс присоединения электронов.
При восстановлении вещество утрачивает кислород или присоединяет водород либо электроны. Реакции окислении снабжают организм энергией. Горение – это реакция окисления; при этом выделяется тепло и свет.
Окислитель – вещество, содержащее восстанавливающий элемент.
Окислитель – элемент, который отдает электроны.
Восстановитель – вещество, содержащее окисляющий элемент.
Восстановитель – элемент, который принимает электроны.
 2018-01-21
2018-01-21 41205
41205
