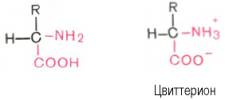
 Эти свойства аминокислот определяют многие физико-химические и биологические свойства белков. На этих свойствах основаны, кроме того, почти все методы выделения и идентификации аминокислот. Аминокислоты легко растворимы в воде. Они кристаллизуются из нейтральных водных растворов в форме биполярных (амфотерных) ионов (цвиттерионов), а не в виде недиссоциированных молекул (последнюю структуру приводят для удобства представления, однако все аминокислоты при физиологических значениях рН имеют структуру цвиттериона).
Эти свойства аминокислот определяют многие физико-химические и биологические свойства белков. На этих свойствах основаны, кроме того, почти все методы выделения и идентификации аминокислот. Аминокислоты легко растворимы в воде. Они кристаллизуются из нейтральных водных растворов в форме биполярных (амфотерных) ионов (цвиттерионов), а не в виде недиссоциированных молекул (последнюю структуру приводят для удобства представления, однако все аминокислоты при физиологических значениях рН имеют структуру цвиттериона).
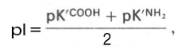 Изоэлектрическая точка аминокислот, не содержащих дополнительных NH2- или СООН-групп, представляет собой среднее арифметическое между двумя значениями рК'.
Изоэлектрическая точка аминокислот, не содержащих дополнительных NH2- или СООН-групп, представляет собой среднее арифметическое между двумя значениями рК'.
Изоэлектрическая точка ряда других аминокислот, содержащих дополнительные кислотные или основные группы, зависит, кроме того, от кислотности или основности радикалов этих аминокислот. Для лизина, например, рI должна вычисляться из полусуммы значений рК' для α- и ε-NН2-групп. Таким образом, в интервале рН от 4,0 до 9,0 почти все аминокислоты существуют преимущественно в форме цвиттерионов с протонированной аминогруппой и диссоциированной карбоксильной группой. Следует отметить, что при физиологических значениях рН тканей и крови (7,1 и 7,4 соответственно) аминокислоты (за ислючением гистидина) не обладают измеримой буферной емкостью. Эту способность они приобретают только при значениях рН, близких к величинам их рК (т.е. при рН 1,7-3,2 и 8,6-10,8).
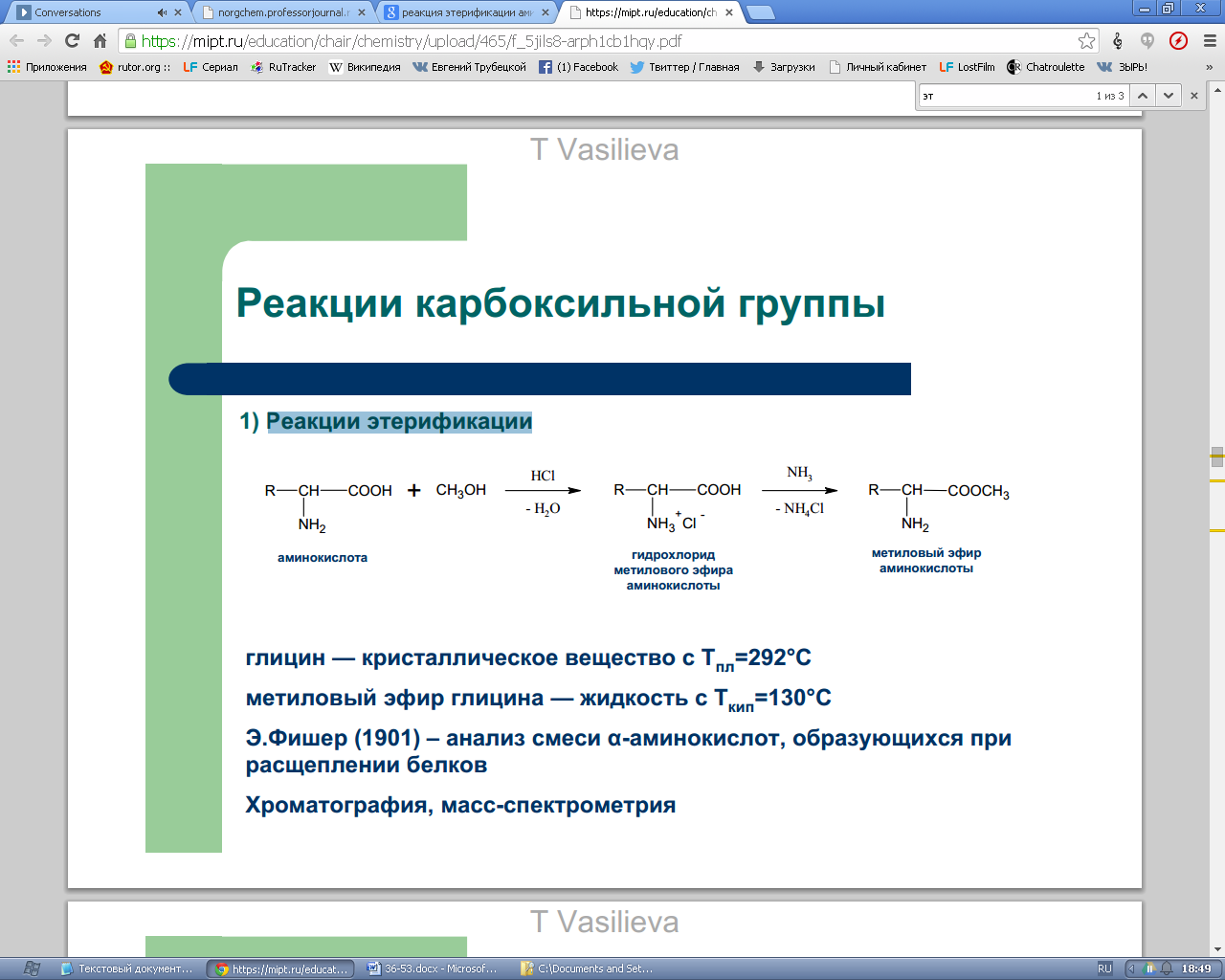
53.Химические свойства α-аминокислот как гетерофункциональных соединений: реакции этерификации, ацилирования, алкилирования, образование иминов, реакция комплексообразования.
 Аминокислоты являются амфотерными соединениями – то есть они взаимодействуют и с кислотами и с основаниями. При этом образуются соли.
Аминокислоты являются амфотерными соединениями – то есть они взаимодействуют и с кислотами и с основаниями. При этом образуются соли.


 Реакция ацилирования. Эта реакция является реакцией ацильного нуклеофильного замещения. Ацетилирование использовалось для защиты аминогруппы в пептидном синтезе.
Реакция ацилирования. Эта реакция является реакцией ацильного нуклеофильного замещения. Ацетилирование использовалось для защиты аминогруппы в пептидном синтезе.
Реакции этерификации.

Алкилирование.
5,4. Биологические важные реакции α-аминокислот
· Дезаминирование (удаление NH2 группы)
неокислительное (без участия кислорода):
окислительное (с участием ферментов дегидрогеназ и кофермента НАД+ или НАДФ+):
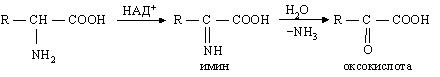
· Трансаминирование.
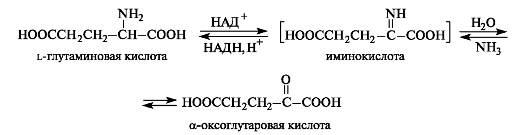
Это основной путь биосинтеза аминокислот из оксокислот. Донором аминогруппы служит аминокислота, имеющаяся в клетках в достаточном количестве или избытке, а ее акцептором — оксокислота. Аминокислота при этом превращается в оксокислоту, а оксокислота — в аминокислоту с соответствующим строением радикалов. В итоге трансаминирование представляет собой обратимый процесс взаимообмена амино- и оксогрупп. Пример такой реакции — получение глутаминовой кислоты из оксоглутаровой кислоты. Донорной аминокислотой может служить, например, аспарагиновая кислота.
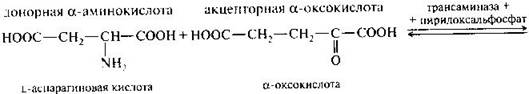
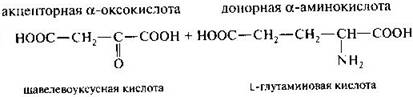
Обратимая реакция – аминирование.
· Гидроксилирование
Например, ферментативное гидроксилирование фенилаланина:
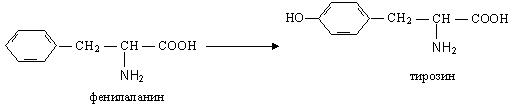
При генетически обусловленном отсутствии в организме фермента, катализирующего этот процесс, развивается тяжелое заболевание — фенилкетонурия
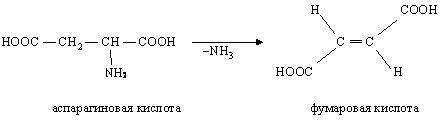
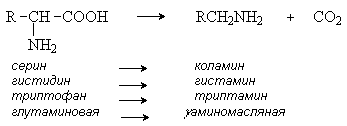
· Декарбоксилирование – процесс отщепления карбоксильной группы аминокислот в виде СО2.
Несмотря на ограниченный круг аминокислот, подвергающихся декарбоксилированию в животных тканях, образующиеся продукты реакции – биогенные амины ( гистамин, g-аминомасляная кислота, серотонин и др.) оказывают сильное фармакологическое действие на физиологические функции организма. Например, гистамин оказывает сосудорасширяющее действие, g-аминомасляная кислота оказывает тормозящее действие на ЦНС.
В живых организмах открыты 4 типа декарбоксилирования аминокислот. Для тканей животных характерно a-декарбоксилирование, при котором от аминокислот отщепляется карбоксильная группа, расположенная по соседству с a-углеродным атомом:

Продуктами реакции являются СО2 и биогенные амины.
Аминокислоты декарбоксилируются под действием ферментов декарбоксилаз при участи кофермента пиридоксальфосфата. При этом образуются биогенные амины.
 !
!
Биогенные амины обладают ярко выраженной биологической активностью. Важнейшими из них являются - коламин (предшественник в синтезе холина и нейромедиатора ацетилхолина), гистамин (обеспечивает аллергические реакции организма), -аминомасляная кислота (нейромедиатор), адреналин (гормон надпочечников, нейромедиатор)
Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот, простетическая группа которых представлена пиридоксальфосфатом, как и у аминотрансфераз. Таким образом, в двух совершенно различных процессах обмена участвует один и тот же кофермент.
Несмотря на ограниченный круг аминокислот, подвергающихся декарбоксилированию в животных тканях, образующиеся продукты реакции – биогенные амины (гистамин, g-аминомасляная кислота и др.) оказывают сильное фармакологическое действие на физиологические функции организма.
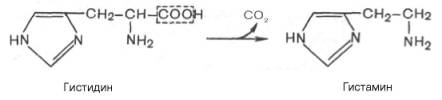
Гистамин образуется при декарбоксилировании гистидина, оказывает широкий спектр биологического действия: вызывает расширение капилляров (обладает сосудорасширяющим действием в отличие от других биогенных аминов), повышение их проницаемости (жидкость из крови выходит в межклеточную среду, что приводит к уменьшению объема крови), понижает АД, стимулирует секруцию желудочного сока и слюны, усиливает секрецию соляной кислоты в желудке; сокращает гладкие мышцы легких, что может вызвать «гистаминовый шок», что проявляется как приступ удушья; участвует в развитии болевых ощущений.
В клинической практике широко используется, кроме того, продукт α-декарбоксилирования глутаминовой кислоты – γ-аминомасляная кислота (ГАМК). Фермент, катализирующий эту реакцию (глутаматдекарбоксилаза), является высокоспецифичным. Интерес к ГАМК объясняется ее тормозящим действием на деятельность ЦНС. Больше всего ГАМК и глутаматдекарбоксилазы обнаружено в сером веществе коры большого мозга, в то время как белое вещество мозга и периферическая нервная система их почти не содержат. Введение ГАМК в организм вызывает разлитой тормозной процесс в коре (центральное торможение) и у животных приводит к утрате условных рефлексов. ГАМК используется в клинике как лекарственное средство при некоторых заболеваниях ЦНС, связанных с резким возбуждением коры большого мозга. Так, при эпилепсии хороший эффект (резкое сокращение частоты эпилептических припадков) дает введение глутаминовой кислоты. Как оказалось, лечебный эффект обусловлен не самой глутаминовой кислотой, а продуктом ее декарбоксилирования – ГАМК.

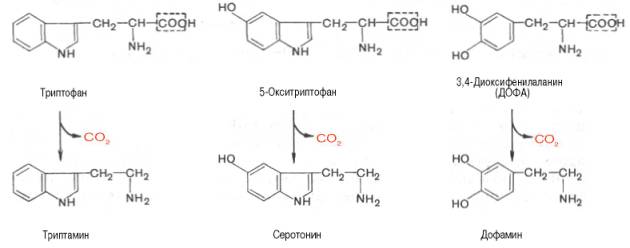
Триптофан – триптамин.
· Окислительное дезаминирование глутаминвоой кислоты
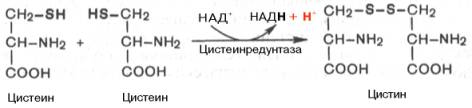
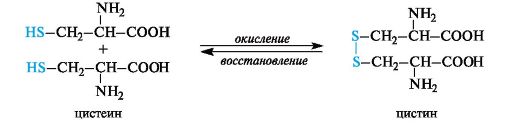
· Окисление цистеина.
 2018-01-21
2018-01-21 5089
5089








