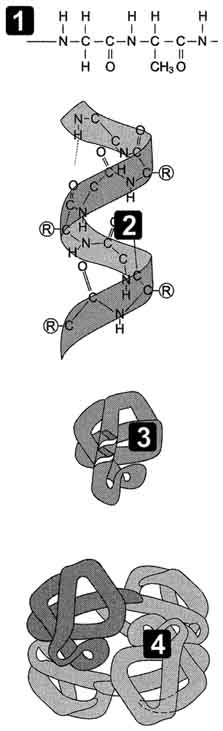
 Л инейные полипептидные цепи индивидуальных белков за счёт взаимодействия функциональных групп аминокислот приобретают определённую пространственную трёхмерную структуру, называемую "конформация". Все молекулы индивидуальных белков (т.е. имеющих одинаковую первичную структуру) образуют в растворе одинаковую конформацию. Следовательно, вся информация, необходимая для формирования пространственных структур, находится в первичной структуре белков.
Л инейные полипептидные цепи индивидуальных белков за счёт взаимодействия функциональных групп аминокислот приобретают определённую пространственную трёхмерную структуру, называемую "конформация". Все молекулы индивидуальных белков (т.е. имеющих одинаковую первичную структуру) образуют в растворе одинаковую конформацию. Следовательно, вся информация, необходимая для формирования пространственных структур, находится в первичной структуре белков.
В белках различают 2 основных типа конформации полипептидных цепей: вторичную и третичную структуры.
2. Вторичная структура белков - пространственная структура, образующаяся в результате взаимодействия между функциональными группами пептидного остова.
При этом пептидные цепи могут приобретать регулярные структуры двух типов: α-спирали
β-структрура Под β-структурой понимают фигуру, подобную листу, сложенному «гармошкой». Фигура формируется за счет образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными группами.
|
|
|
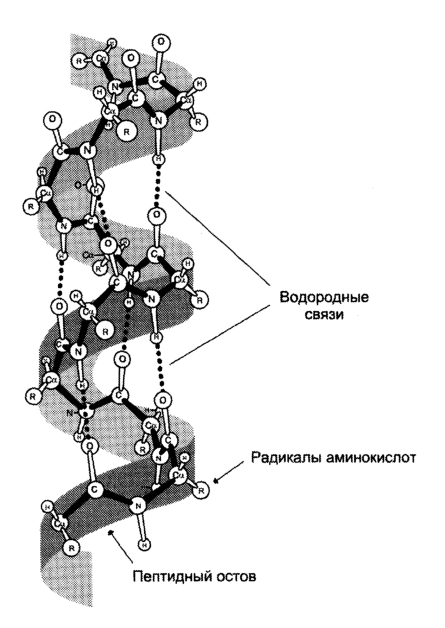
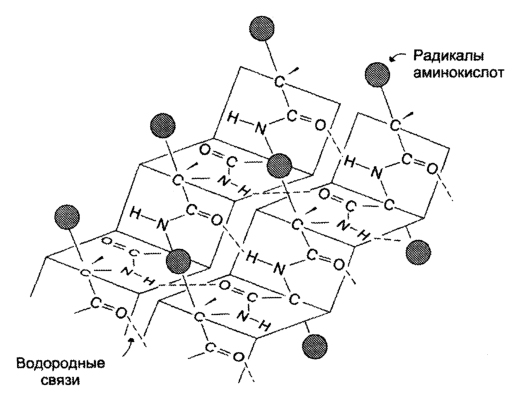
Связи - водородные, они стабилизируют отдельные фрагменты макромолекул.
3. Третичная структура белков - трёхмерная пространственная структура, образующаяся за счёт взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль
стабилизации третичной структуры белка принимают участие:
· ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
· ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
· гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
4. Четвертичной структурой называют взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
|
|
|
Роль.
Образование пептидов в организме происходит в течение нескольких минут, химический же синтез в условиях лаборатории — достаточно длительный процесс, который может занимать несколько дней, а разработка технологии синтеза – несколько лет. Однако, несмотря на это, существуют довольно весомые аргументы в пользу проведения работ по синтезу аналогов природных пептидов. Во-первых, путём химической модификации пептидов возможно подтвердить гипотезу первичной структуры. Аминокислотные последовательности некоторых гормонов стали известны именно благодаря синтезу их аналогов в лаборатории.
Во-вторых, синтетические пептиды позволяют подробнее изучить связь между структурой аминокислотной последовательности и её активностью. Для выяснения связи между конкретной структурой пептида и его биологической активностью была проведена огромная работа по синтезу не одной тысячи аналогов. В результате удалось выяснить, что замена лишь одной аминокислоты в структуре пептида способна в несколько раз увеличить его биологическую активность или изменить её направленность. А изменение длины аминокислотной последовательности помогает определить расположение активных центров пептида и участка рецепторного взаимодействия.
В-третьих, благодаря модификации исходной аминокислотной последовательности, появилась возможность получать фармакологические препараты. Создание аналогов природных пептидов позволяет выявить более «эффективные» конфигурации молекул, которые усиливают биологическое действие или делают его более продолжительным.
В-четвёртых, химический синтез пептидов экономически выгоден. Большинство терапевтических препаратов стоили бы в десятки раз больше, если бы были сделаны на основе природного продукта.
Зачастую активные пептиды в природе обнаруживаются лишь в нанограммовых количествах. Плюс к этому, методы очистки и выделения пептидов из природных источников не могут полностью разделить искомую аминокислотную последовательность с пептидами противоположного или же иного действия. А в случае специфических пептидов, синтезируемых организмом человека, получить их возможно лишь путём синтеза в лабораторных условиях.
57. Классификация белков: простые и сложные, глобулярные и фибриллярные, мономерные и олигомерные. Функции белков в организме.
Классификация по типу строения
По общему типу строения белки можно разбить на три группы:
1. Фибриллярные белки — образуют полимеры, их структура обычно высокорегулярна и поддерживается, в основном, взаимодействиями между разными цепями. Они образуют микрофиламенты, микротрубочки, фибриллы, поддерживают структуру клеток и тканей. К фибриллярным белкам относятся кератин и коллаген.
2. Глобулярные белки — водорастворимы, общая форма молекулы более или менее сферическая.
3. Мембранные белки — имеют пересекающие клеточную мембрану домены, но части их выступают из мембраны в межклеточное окружение и цитоплазму клетки. Мембранные белки выполняют функцию рецепторов, то есть осуществляют передачу сигналов, а также обеспечивают трансмембранный транспорт различных веществ. Белки-транспортёры специфичны, каждый из них пропускает через мембрану только определённые молекулы или определённый тип сигнала.
Простые белки, Сложные белки
Помимо пептидных цепей, в состав многих белков входят и неаминокислотные группы, и по этому критерию белки делят на две большие группы — простые и сложные белки (протеиды). Простые белки состоят только из полипептидных цепей, сложные белки содержат также неаминокислотные, или простетические, группы.
|
|
|
Простые.
Среди глобулярных белков можно выделить:
1. альбумины — растворимы в воде в широком интервале рН (от 4 до 8,5), осаждаются 70-100%-ным раствором сульфата аммония;
2. полифункциональные глобулины с большей молекулярной массой, труднее растворимы в воде, растворимы в солевых растворах, часто содержат углеводную часть;
3. гистоны — низкомолекулярные белки с высоким содержанием в молекуле остатков аргинина и лизина, что обусловливает их основные свойства;
4. протамины отличаются еще более высоким содержанием аргинина (до 85 %), как и гистоны, образуют устойчивые ассоциаты с нуклеиновыми кислотами, выступают как регуляторные и репрессорные белки — составная часть нуклеопротеинов;
5. проламины характеризуются высоким содержанием глутаминовой кислоты (30-45 %) и пролина (до 15 %), нерастворимы в воде, растворяются в 50-90 % этаноле;
6. глутелины содержат около 45 % глутаминовой кислоты, как и проламины, чаще содержатся в белках злаков.
Фибриллярные белки характеризуются волокнистой структурой, практически нерастворимы в воде и солевых растворах. Полипептидные цепи в молекулах расположены параллельно одна другой. Участвуют в образовании структурных элементов соединительной ткани (коллагены, кератины, эластины).
Сло?жные белки?
(протеиды, холопротеины) — двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы — простетическая группа. При гидролизе сложных белков, кроме аминокислот, освобождается небелковая часть или продукты её распада.
В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества.
В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы[1]:
· Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и их подкласс — протеогликаны, с мукополисахаридными простетическими группами. В образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет ~95 %, они являются основным компонентом межклеточного матрикса.
|
|
|
· Липопротеиды, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеиды, образованные белками-аполипопротеинами связывающимися с ними липидами и выполняют функцию транспорта липидов.
· Металлопротеиды, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов)
· Нуклеопротеиды, содержащие нековалентно связанные ДНК или РНК, в частности, хроматин, из которого состоят хромосомы, является нуклеопротеидом[2].
· Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина или треонина, фосфопротеинами являются, в частности, казеин молока[3]:
· Хромопротеиды — собирательное название сложных белков с окрашенными простетическими группами различной химической природы. К ним относится множество белков с металлсодержащейпорфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки, содержащие в качестве простетической группы гем — гемоглобин, цитохромы и др.), хлорофиллы;флавопротеиды с флавиновой группой, и др.
Функции.
1. Структурная функция
2. Защитная функция
3. Регуляторная функция
4. Сигнальная функция
6. Запасная (резервная) функция
7. Рецепторная функция
8. Моторная (двигательная) функция
 2018-01-21
2018-01-21 31665
31665
