В ряде случаев метод валентных связей не может объяснить образования химических связей. Например, существует ион H2+, в составе которого находится всего лишь один электрон и, следовательно, не может образоваться электронной пары.
Этот и другие подобные ему факты можно объяснить на основе метода молекулярных орбиталей (МО), который предложил американский ученый Роберт СандерсонМалликен (1896-1986) в 1930 г.
Химическая связь рассматривается в этом случае как результат распределения электронов в молекуле по соответствующим молекулярным орбиталям. Для описания молекулы следует определить тип ее молекулярных орбиталей и распределение по ним электронов. В состав молекулы могут входить несколько атомов, поэтому молекулярное электронное облако принадлежит одновременно нескольким ядрам и возникает многоцентровая химическая связь.
В первом приближении молекулярныеорбитали можно рассматривать как линейную комбинацию атомных орбиталей (ЛКАО). При этом из n атомныхорбиталей образуется n молекулярных орбиталей.
Заселение электронами молекулярных орбиталей подчиняется тем же закономерностям, что и заселение атомных орбиталей:
1.Принцип Паули. На каждой МО может находиться не более чем два электрона, причем с противоположно направленными спинами.
2. Правило Хунда (трамвайное правило)
В наиболее устойчивом состоянии молекулы электроны размещаются в пределах МО так, чтобы их суммарный спин был максимален.
3. Принцип минимума энергии. МО заселяются последовательно в порядке возрастания их энергии. Образование химической связи с точки зрения метода молекулярных орбиталей происходит тогда, когда суммарная энергия электронов на молекулярных орбиталях оказывается меньше, чем суммарная энергия этих электронов на атомных орбиталях.
Молекула водорода
На схеме показано образование молекулы водорода. Из двух 1s – орбиталей атомов водорода возникают две молекулярные орбитали. Одна из них сигма-связывающая σ1sсв, другая сигма-разрыхляющая σ1sразр. Связывающая орбиталь обладает меньшей энергией, чем исходные атомные орбитали, а разрыхляющая большей. Поэтому электроны переходят на связывающуюорбиталь – см. рисунки 7 и 8.
2 H (1s1) → H2 [(σсв.1s)2] - 435 кДж
Уменьшение энергии при переходе электронов с атомных на молекулярные орбитали и делает возможным образование химической связи и, соответственно, молекулы водорода.

Рис.7 Образование молекулярныхорбиталей в молекуле водорода

Рис.8. Образование связывающей орбитали в молекуле водорода
Метод МО позволяет объяснить факт существования иона H2+. При его образовании единственный электрон переходит с атомной орбитали 1 s на связывающуюорбитальσсв.1s, что энергетически выгодно и сопровождается выделением энергии:
H (1s1) + H+ → H2+[(σсв.1s)1] + 259 кДж
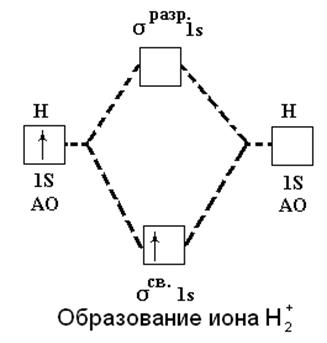
Рис.9. Образование иона водорода
Метод МО позволяет объяснить и то, почему не могут существовать некоторые частицы. Например, экспериментально обнаружен молекулярный ион He2+. Из трех электронов, входящих в его состав, два занимают связывающую (σ1sсв.)2 орбиталь, энергия которой меньше, чем у исходных 1s орбиталей, и один разрыхляющую σ1sразр, энергия которой больше исходных 1s орбиталей. В итоге энергия молекулярного иона гелия оказывается меньше, чем суммарная энергия исходных атома и иона гелия, что и определяет возможность его существования. Однако в молекуле гелия He2, если бы таковая существовала, число электронов на связывающей и разрыхляющей орбиталях было бы одинаково и равно двум. Поэтому энергетического выигрыша по сравнению с суммарной энергией двух атомов гелия быть не может, именно поэтому молекул гелия не существует.
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов).
По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми.
Компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные составляющие раствора – растворенными веществами.
В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе.
В зависимости от размеров частиц растворы делятся на истинные и коллоидные.
В истинных растворах (часто называемых просто растворами) растворенное вещество диспергировано до атомного или молекулярного уровня. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.
Движущими силами образования растворов являются энтропийный и энтальпийный факторы.
1. При растворении газов в жидкости энтропия всегда уменьшается ΔS < 0, а при растворении кристаллов возрастает (ΔS > 0).
2. Чем сильнее взаимодействие растворенного вещества и растворителя, тем больше роль энтальпийного фактора в образовании растворов. Знак изменения энтальпии растворения определяется знаком суммы всех тепловых эффектов процессов, сопровождающих растворение, из которых основной вклад вносят разрушение кристаллической решетки на свободные ионы (ΔH > 0) и взаимодействие образовавшихся ионов с молекулами растворителя (сольтивация, ΔH < 0).
Независимо от знака энтальпии при растворении всегда:
ΔG = ΔH – T∙ΔS < 0
Способность вещества растворяться в том или ином растворителе называется растворимостью. Количественно растворимость вещества часто выражается массой вещества, растворяющегося в 100 г растворителя.
Таблица 6. Растворимость веществ в воде
| Растворимость, г/100 г растворителя | Характеристика вещества | Пример |
| Более 10 | Хорошо растворимое | Нитрат калия |
| 10-1 | Растворимое | Хлорид натрия |
| Меньше 1 | Малорастворимое | Сульфат кальция |
| Меньше 0,01 | Практически нерастворимое | Иодид серебра |
Растворимость для различных веществ колеблется в значительных пределах и зависит от их природы, взаимодействия частиц растворенного вещества между собой и с молекулами растворителя, а также от внешних условий (давления, температуры и т. д.)
Растворы делятся на идеальные и реальные. Для идеальных растворов взаимодействием между компонентами раствора можно пренебречь. Следовательно, свойства раствора определяются как сумма свойств растворенных веществ. Например, при смешении близких по свойствам бензола и толуола давление пара P над раствором в соответствии с законом Дальтона будет аддитивной (получаемой сложением) величиной:
P = χ(Б) Pб0 + χ(Т)PT0
Здесь и χ(Б), и χ(T) – соответственно молярные доли бензола и толуола.
Если раствор сохраняет свойства идеальности при любых концентрациях, его называют совершенным (растворы изотопов). Часто раствор приобретает эти качества только при достаточно большом разведении, это – «бесконечно разбавленный» раствор при χ→0. Во всех прочих случаях раствор считается реальным.
Если растворенное вещество характеризуется большой упругостью пара по сравнению с упругостью пара растворителя (PB >> PA) и при этом оба компонента раствора химически инертны, то растворение такого газообразного вещества в жидкости подчиняется закону Генри: при постоянной температуре давление летучего (газообразного) компонента PB прямо пропорционально его мольной доле χB:
PB = KHχ(B)
Если упругость пара растворенного вещества очень мала PB<<PA, то его парциальным давлением можно пренебречь (нелетучий компонент), и тогда упругость пара над раствором будет зависеть только от парциального давления растворителя:


Это первый закон Рауля – парциальное давление над раствором прямо пропорционально мольной доле растворителя.
После подстановки 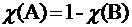 и несложных преобразований
и несложных преобразований
получаем:

Относительное понижение упругости пара над раствором равно молярной доле растворенного вещества. Это закон Рауля для нелетучего растворенного компонента. Из этого закона можно вывести два следствия, которые в объединенном виде  формируются как второй закон Рауля – повышение температуры кипения и понижение температуры замерзания раствора прямо пропорционально моляльной концентрации растворенного вещества:
формируются как второй закон Рауля – повышение температуры кипения и понижение температуры замерзания раствора прямо пропорционально моляльной концентрации растворенного вещества:
ΔT = KCm (B) 
Коэффициенты пропорциональности носят, соответственно, название эбулиоскопического (определяет повышение температуры кипения раствора по отношению к температуре кипения растворителя) и криоскопического (определяет понижение температуры замерзания раствора по отношению к температуре замерзания растворителя).
Таблица 7. Эбуллиоскопические и криоскопические константы некоторых растворителей
| Растворитель | Кэбул., 0С×кг/моль | Ккрио., 0С×кг/моль |
| Вода | 0,52 | 1,86 |
| Бензол | 2,57 | 5,10 |
| Анилин | 3,69 | 5,87 |
Эбулиоскопический и криоскопический коэффициенты определяются только природой растворителя (см. табл.7).
Второй закон Рауля дает легко осуществимую экспериментально возможность определения молекулярных масс некоторых молекулярных соединений, неспособных к диссоциации в данном растворителе. Действительно, моляльная концентрация растворенного вещества может быть представлена в виде соотношения:
Cm(B) = 
где: m(B) – масса растворенного вещества, г;
m(A) – масса растворителя, кг;
M(B) – молярная масса растворенного вещества, г/моль.
ΔT = KCm (B) = 
Экспериментально определив ΔT и подставив в уравнение наряду с K, массой растворенного вещества и массой растворителя мы получим уравнение с одним неизвесным - молярной массой растворенного вещества.
Если разделить мембраной, через которую способны проходить только молекулы растворителя, два раствора, в которых различны концентрации растворенного вещества χ1(B) и χ2(B), то возникнет процесс перехода через мембрану растворителя из того раствора, где концентрация растворенного вещества ниже в тот раствор, где концентрация растворенного вещества выше.
 2018-01-21
2018-01-21 1065
1065
