Закон Рауля и следствия из него; понижение температуры кристаллизации; повышение температуры кипения растворов, осмос. Осмотическое давление, Закон Вант-Гофа. Осмотические свойства растворов электролитов. Гипо-, гипер- и изотонические растворы. Изотонический коэффициент. Понятие о изоосмии (электролитном гомеостазе). Роль осмоса в биологических системах. Плазмолиз и гемолиз:
11.1. Коллигативные свойства разбавленных растворов -это те их свойства,которые при данных условиях оказываются равными и независимыми от химической природырастворённого вещества; свойства растворов, которые зависят лишь от количества кинетических единиц и от их теплового движения: понижение давления пара, повышение температуры кипения, понижение температуры замерзания, осмотическое давление.
11.2. Закон Рауля и следствие из него - Пар, находящийся в равновесии с жидкостью, называют насыщенным. Давление такого пара над чистым растворителем (p0) называют давлением или упругостью насыщенного пара чистого растворителя. Следствия: 1)температура кипения раствора выше температуры кипения растворителя.Это обусловлено тем, что давление насыщенного пара растворителя над раствором становится равным атмосферному давлению при более высокой температуре, чем в случае чистого растворителя. 2) температура замерзанияраствора ниже температуры замерзания чистого растворителя. Это обусловлено более низким давлением пара растворителянад раствором, чем над растворителем.
11.3. Понижение температуры кристаллизации – является температура, при которой давление пара над жидкостью равно давлению пара над твердой фазой. П овышение температуры кипения растворов– является температура, при которой давление ее паров становится равным внешнему давлению. Осмос – это преимущественно одностороннее проникновение молекул растворителя через полупроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией.
11.4. Осмотическое давление – величина, измеряемая минимальное гидравлическое давление, которое нужно приложить к раствору, чтобы осмос прекратился.
11.5. Закон Вант-Гофа – предложил эмпирическое уравнение для расчета осмотического давления разбавленных растворов неэлектролитов: p = с(x)RТ, p – осмотическое давление (кПа), с – молярная концентрация раствора.
11.6. Изотонический коэффициент —безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы.
11.7. Изоосмия -относительное постоянство осмотического давления в жидких средах и тканяхорганизма, обусловленное поддержанием на данном уровне концентраций содержащихся в нихвеществ: электролитов, белков.Это одна из важнейших физиологических констант организма,обеспечиваемых механизмами саморегуляции (Гомеостаз). ГЕМОЛИЗ - разрушение эритроцитов,сопровождающееся выходом из них гемоглобина. Физические причины относится действие высоких инизких температур, ультразвука, к химическим - гемолитические яды, нек-рые лекарственные средстваи др. Гемолиз может возникнуть при переливании несовместимой крови, введении гипотонических растворов. Плазмолиз -при помещении клеток в гипертонический раствор вода из клеток уходит в болееконцентрированный раствор и наблюдается сморщивание клеток.
11.8. Осмос играет очень важную роль в биологических процессах, обеспечивая поступление воды в клетки и другие структуры.
12. Элементы теории растворов электролитов. Сильные и слабые электролиты. Константа ионизации слабого электролита. Закон разведения Оствальда. Ионная сила раствора. Активность и коэффициент активности ионов. Электролиты в организме:
12.1. Электролиты – это вещества с ионными или сильнополярными ковалентными связями в водныхрастворах, подвергающиеся электролитической диссоциации, в результат чего образуются катионы и анионы. Сильные электролиты – вещества, способные диссоциировать нацело. К ним относится большинство солей, а так же некоторые вещества молекулярного строения (HCl). Слабые электролиты диссоциируют в незначительно степени, и преобладающей формой их является молекулярная (H2S, органические кислоты).
12.2. Закон разбавления Оствальда: K= α2c/1- α,Где α – степень ионизацииС – молярная концентрация.
12.3. Ионная сила раствора: I=0.5Σсizi (2 над),Где сi – молярная концентрация иона в растворе, моль/лzi – заряд иона.
12.4. Активность иона – это его эффективная концентрация.Активность связана с молярной концентрацией следующим образом: a=f*c,где f – коэффициент активности.Электролиты в организме: Na и Cl участвуют в поддержании кислотно-щелочного баланса,осмотического равновесия в организме. Са играет большую роль в построении костной ткани и зубов, врегулировании кислотности крови и ее свертывании, в возбудимости мышечной и нервной ткани. К находится преимущественно в жидкостях тела и мягких тканях, где является необходимым элементомдля поддержания осмотического давления, регуляции рН крови. Mg является кофактором многихферментативных реакций, необходим на всех этапах синтеза белка. В живых организмах Fe являетсяважным микроэлементом, катализирующим процессы обмена кислородом. Сo входит в составвитамина В12, задействован при кроветворении, функциях нервной системы и печени, ферментативныхреакциях. Zn необходим дляметаболизма витамина Е, участвует в синтезе разных анаболическихгормонов в организме, включая инсулин, тестостерон и гормон роста. Mn оказывает влияние на рост,образование крови и функции половых желёз.
13. Основные положения протолитической теории кислот и оснований Бренстеда-Лоури, сопряженная протолитическая пара, амфолиты. ТеорияЛьюиса:
13.1. Теория Бренстеда-Лоури: кислотой называют всякое вещество, молекулярные частицы которого(в томчисле и ионы) способны отдавать протон, т.е. быть донором протонов; основанием называютвсякое вещество, молекулярные частицы которого(в том числе и ионы) способны присоединитьпротоны, т.е. быть акцептором протонов.
Например: HNO3 + H2O= H3O+ + NO3 Молекула и ион, отличающиеся по составу на один протон, называются сопряженной кислотно-основной парой. Частицы, способные к взаимодействию как с кислотами, так и с основаниями, называются амфолитами. Теория Льюиса: кислотой называют вещество, принимающие электронные пары, - акцептор электронов; основанием называют вещество, поставляющее электроны для образования химической связи, - донор электронов. Например: NH3 + HCI=NH4CI.
13.2. Амфоли́ты — молекулы, в структуре которых присутствуют как кислотные, так и основные группы, существующие в виде цвиттер-ионов при определённых значених pH. Этот pH обозначается как изоэлектрическая точка молекулы. Амфолиты образуют растворы с хорошими буферными свойствами. Благодаря способности к выборочной ионизации они противодействуют изменению pH при добавлении кислоты или основания. В присутствии кислот они принимают на себя протоны, удаляя последние из раствора, и противодействуют повышению его кислотности. При добавлении оснований амфолиты высвобождают ионы водорода в раствор, препятствуя возрастанию pH, и тем сохраняя его равновесие.
14. Автопротолиз воды. Константа автопротолиза воды. Водородный показатель.
14.1. Автопротолиз –обратимый процесс образования равного числа катионов и анионов изнезаряженных молекул жидкого индивидуального вещества за счет передачи протона от одноймолекулы к другой. H2O + H2O= H3O+ + OH–. Это равновесие называется равновесиемавтопротолиза воды.
14.2. Константа автопротолиза для воды обычно называется ионным произведением воды и обозначается как Kw. Ионное произведение численно равно произведению равновесных концентраций ионов гидроксония и гидроксид-анионов. Обычно используется упрощенная запись:
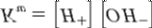
14.3. pH — это водородный показатель — мера активности (в случае разбавленных растворов отражаетконцентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляетсякак отрицательный (взятый с обратным знаком) десятичный логарифм концентрации водородныхионов, выраженной в молях на литр: pH = -log[H+]. Т.е. рН определяется количественным соотношениемв воде ионов Н+ и ОН-, образующихся при диссоциации воды.
 2018-01-21
2018-01-21 1858
1858
