Химические источники тока
Химическими источниками тока называются устройства, в которых энергия химической реакции непосредственно превращается в электрическую энергию.
Химические источники тока делятся:
- гальванические элементы;
- аккумуляторы;
К первой группе относятся источники однократного использования. Срок службы гальванического элемента заканчивается, когда вещества участвующие в химической реакции полностью или частично израсходованы.
Ко второй группе относятся источники тока многократного использования. Они обладают способностью аккумулировать подведенную извне электрическую энергию.
Теоретически для получения электрической энергии можно применить любую окислительно-восстановительную реакцию.
Сu / CuSO4 // Zn / ZnSO4
Простейшим гальваническим элементом является медно-цинковый элемент Даниэля-Якоби.
Гальванический элемент – устройство, в котором химическая энергия реакции окисления-восстановления преобразуется в электрическую.
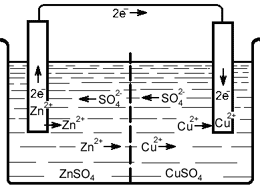
Он состоит из медного и цинкового электродов, погруженных соответственно в растворы сульфатов меди цинка. Оба раствора отделаны друг от друга пористой перегородкой. Сосуды с растворами соединены U образной трубкой, заполняемой каким-либо электролитом. Электроды соединены металлически проводником.
Каждый металл, погруженный в раствор своей соли, приобретает определенный электродный потенциал, значение которого приведено в электрохимическом ряду напряжений. Из-за различия электродных потенциалов между электродами возникает разность потенциалов. Если замкнуть на внешнюю электрическую цепь, возникает электрический ток. При этом цинковый электрод постоянно растворяется в электролите его реакции:
Zn0 = Zn2+ - 2e (окисление) А
а на медном электроде осождаются из электролита катионы меди.
Cu2++ 2e = Cu0 (восстановление) К
Рис. 1 Схема движения ионов и электронов при работе медно-цинкового гальванического элемента.
За счет протекания этих реакций элемент Даниэля-Якоби вырабатывает электрический ток.
В химических источниках тока электрод на котором протекает электрохимическое окисление, называется анодом.
Электрод на котором происходит электрохимическое восстановление называется катодом.
Электродвижущая сила (ЭДС) химического источника тока равна разности электродных потенциалов катода и анода.
ЭДС= К – А (Cu - Zn)
E0= E0 Cu2+ / Cu0 - E Zn0 /Zn2+
∆E= E0 окислителя – E0 восстановителя > 0 реакция протекает
∆E < 0 реакция не протекает.
Более активный металл (с меньшим значением электродного потенциала Ц0) служит анодом -, на нем идут процессы окисления – отдача электронов. Менее активный металл (с большим значением электродного потенциала Ц0) служит катодом + на нем идут процессы восстановления.
Условная схема гальванического элемента
анод/ анодный раствор // катодный раствор/ катод
Zn0 / Zn2+SO4 // Cu2+SO4 / Сu0
окисление А К восстановление
ЭДС = К – А
При его работе цинковая пластина (Zn) окисляется (ионы цинка переходят в анодное пространство, а электроны от цинка, подойдя к медной пластинке восстанавливают ионы меди(Cu)).
Анод (-) Zn0 – 2e = Zn2+ (окисление)
Катод (+) Cu2++ 2e = Cu0 (восстановление)
Суммарный процесс: Zn0 + Cu2+=Zn2++ Сu0
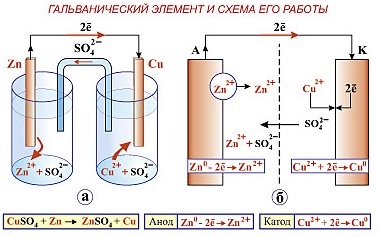
Рис. 2 Гальванический элемент и схема его работы.
Энергия этой окислительно-восстановительной реакции превращается в электрическую. Каждый металл, погруженный в раствор своей соли, приобретает определенный электродный потенциал значение которого приведено в электрохимическом ряду напряжений. Из-за различия электродных потенциалов между электродами возникает разность потенциалов.
Важнейшей характеристикой гальванического элемента является электродвижущая сила Е0 (ЭДС). ЭДС- разность потенциалов катода и анода при разомкнутой цепи.
ЭДС= К-А
Для медно-цинкового гальванического элемента ЭДС
Е0=(Ц)Е0Cu-Е0Zn=0,34-(-0,76)=1,1В
∆E0= E0 окислителя – E0 восстановителя
∆E > 0 реакция протекает
∆E < 0 реакция не протекает
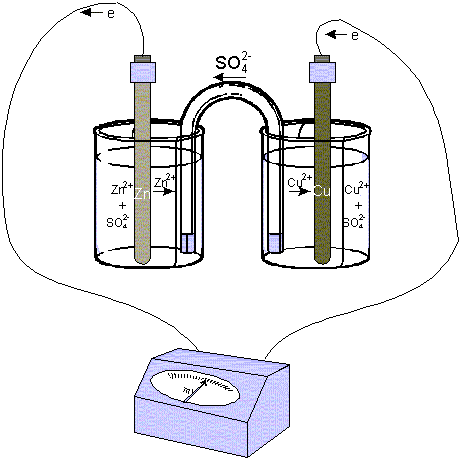
Рис. 3 Гальванический элемент Даниэля Якоби
Гальванический элемент, электроды которого из одного и того же металла погруженные в растворы с различной концентрацией катионов этого металла, называется концентрационным. В соответствии с формулой уравнения Нернста.
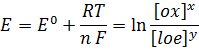
или 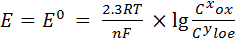
где:
· 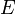 — электродный потенциал,
— электродный потенциал, 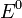 — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
· 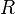 — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
· 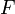 — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;
· 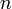 — число моль электронов, участвующих в процессе;
— число моль электронов, участвующих в процессе;
· x,y — коэффициенты в уравнении реакции;
· Сox, C loe — концентрации окислительной и восстановительной форм реагентов.
Электрод в растворе с меньшей концентрацией (С1) будет выполнять роль анода, а электрод в растворе с большей концентрацией (С2)- роль катода.
(-) Mn / MnSO4 // MnSO4 / Mn (+)
C1 C2
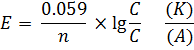
ОВР идет самопроизвольно, если разность потенциалов окислительно-восстановительной погрешности больше нуля.
∆E(ОВР)= E0 окислителя – E0 восстановителя > 0
Значение потенциалов различных ОВР пар приведены в таблицах. В таблице приводятся числовые значения потенциалов в порядке убывания электрохимической активности металлов по сравнению с потенциалом системы 2Н+ / H20 принятым равным нулю, при стандартных условиях (Т = 298К, С(H+)= 1 моль/дм3, P= 1амп=101,3КПа).
 2018-01-21
2018-01-21 2212
2212
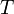 —
—