Процессы взаимного превращения химической и электрической форм энергии называют электрохимическими процессами.
Электрохимические процессы можно разделить на две основные группы:
- процессы превращения химической энергии в электрическую (гальванические элементы, аккумуляторы);
- процессы превращения электрической энергии в химическую (Электролиз).
Рассмотрим процессы, протекающие при погружении металлов в раствор собственных ионов. Согласно современным представлениям, в металле одновременно имеются: нейтральные атомы, ионы и свободные электроны. В узлах кристаллической металла решетки расположены ионы находящиеся в равновесии со свободными электронами:
Me+ • e → Me+ + e
При погружении металла в раствор начинается сложное взаимодействие металла с компонентами раствора. Наиболее важной является реакция поверхностных ионов металла, находящихся в узлах решетки, с полярными молекулами воды, ориентированными у поверхности электрода.
Любой металл хотя бы в ничтожной степени растворяется в воде, что обусловлено возрастанием энтропии при растворении (∆S>0).
Реакция между металлом и водой будет гетерогенной, поэтому будет протекать на границе раздела фаз.
Если металлическую пластинку погрузить в воду, то под действием полярных молекул воды ионы металла отрываются от кристаллической решетки металла, с его поверхности и гидротированными (окруженными дополнительными молекулами воды) переходят в жидкую фазу.
Появление избытка положительно заряженных ионов металла в воде приводит к тому, что жидкая фаза заряжается положительно («+»).
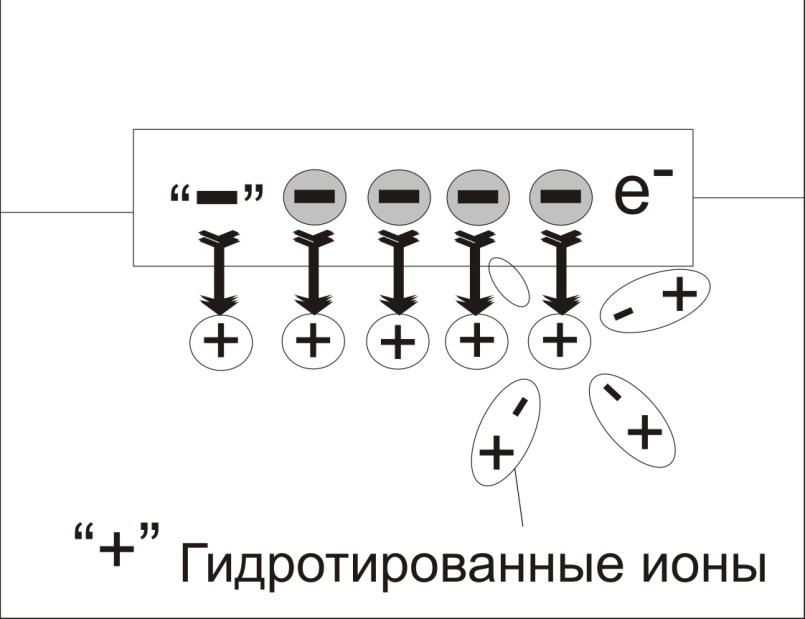 В металле остаются электроны, заряд которых уже не скомпенсирован положительно заряженными ионами в металле. Избыток электронов на металлической пластинке создает отрицательный заряд («-»).
В металле остаются электроны, заряд которых уже не скомпенсирован положительно заряженными ионами в металле. Избыток электронов на металлической пластинке создает отрицательный заряд («-»).
Me0 + mH2O → Me (H2O) mn+ + n e -
Гидротированные ионы
В результате взаимодействия происходит окисление металла и его гидротированные ионы переходят в раствор, оставляя в металле электроны, заряд которых не скомпенсирован положительно заряженными ионами в металле.
Между металлами и раствором возникает разность потенциалов, которая называется электродным потенциалом или потенциалом электрода.
По мере перепада ионов в раствор растет отрицательный заряд поверхности металлической пластинки. Она начинает притягивать к себе положительно заряженные ионы металла, которые уже перешли в раствор и, таким образом, катионы («+») не могут свободно перемещаться в оббьем раствора. Протекает обратная реакция – восстановление ионов металла до атомов.
Me (H2O) mn+ + n e - → Me0 + mH2O
Таким образом, на границе металл-раствор возникает двойной электрический слой. С увеличением скачка потенциала между электродом и раствором скорость прямой реакции падает, а обратной растет. При некотором значении электродного потенциала скорость прямого процесса будет равна скорости обратного процесса, устанавливается равновесие:
Me0 + mH2O ↔ Me (H2O) mn+ + n e -
Для упрощения гидротационную воду обычно в уравнение реакции не включают и оно записывается в виде:
Me0 ↔ Me n+ + n e -
n – степень окисления металла.
Равновесие имеет динамический характер, процессы при равновесии идут с одинаковой скоростью в прямом и обратном направлениях. Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
Абсолютное значение электродных потенциалов экспериментально определить невозможно. Однако, можно определить разность электродных потенциалов. Поэтому для характеристики электродных потенциалов пользуются относительными значениями электродных потенциалов. Для этого находят разность потенциалов измеряемого электрода и электрода, потенциал которого условно принимают равным нулю.
Если металлический электрод погрузить в раствор его соли, то процессы, протекающие на границе металл – раствор, будут аналогичны рассмотренным выше, отличие соединений лишь в том, что для достижения равновесия при образовании двойного электрического слоя требуется меньше растворения металла, так как частично ионы металла уже присутствуют в растворе его соли.
Очевидно, чем выше концентрация соли в растворе, тем меньшей должна быть величина скачка потенциала на границе металл – раствор. Таким образом, она зависит от: 1) температуры; 2) от соотношения между концентрациями этих веществ; 3) от природы металла, участвующих в электродном процессе.
Поэтому для сравнения электродных потенциалов необходимо выбрать: t=250C=298K, P=101.3 кПа, активность иона равна 1 в растворе с концентрацией 1 моль/л.
Металл погрузить в раствор своих ионов (например, Zn в раствор ZnSO4).
Если концентрация в растворе ZnSO4 не велика, то образование двойного электрического слоя будет происходить так же, как и в случае растворения металла в воде. Если же концентрация ионов в растворе велика, то сначала будет наблюдаться осаждение катионов из поверхности металла, которая зарядится положительно.
Теперь поверхность металла будет притягивать к себе отрицательные ионы (в нашем примере SO42-), и образуется двойной электрический слой с положительной обкладкой из металла и отрицательной – из растворенных анионов. Катионы будут осаждаться до тех пор, пока заряд на поверхности не достигнет такой величины, при которой дальнейшее осаждение станет невозможным из – за отталкивания одноименных зарядов металлов и его ионов.
Когда имеются два противоположно заряженных тела, говорят, что между ними существует разность потенциалов. Такая разность потенциалов устанавливается и здесь, в двойном электрическом слое, на границе металл – раствор. Перепад ионов из металла в раствор и обратно создает между ними разность потенциалов. Пару металл – раствор принято называть электродом.
Абсолютное значение электродных потенциалов экспериментально определить невозможно, так как введение любых измерительных зондов неизбежно приводит к появлению новой контактной разности потенциалов. В связи с этим измеряют разность потенциалов между данным электродо и некоторым электродом сравнения, потенциал которого условно принимают равным нулю.
В качестве стандартного электрода сравнения используют стандартный водородный электрод.
Стандартный водородный электрод
Водородный электрод представляет собой платиновую пластинку, покрытую тонким слоем рыхлой пористой платины (для увеличения поверхности электрода) и опущена в водный раствор H2SO4 с активностью ионов водорода равным 1 моль/л и при давлении равным 1(100 кПа).
Через раствор серной кислоты пропускают водород под атмосферным давлением 100 кПа. Часто поглощенного платиной водорода переходить в атомное состояние, поэтому в поверхностном слое платины устанавливается равновесие водорода с собственными катионами.
При контакте платины с молекулярным водородом происходить адсорбция водорода на платине. Адсорбционный водород взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя в платине электроны. При этом платина заряжается «-», а раствор положительно «+». Возникает скачек потенциала между платиной и раствором. Наряду с перепадом ионов в раствор идет обратный процесс восстановления ионов водорода с образованием молекул водорода. Равновесие на водородном электроде можно представить: 2 H+ + 2 e- ↔ H20
Абсолютное значение потенциала водородного электрода неизвестно, но его условно считают равным нулю. Это и есть потенциал водородного электрода.
Если из всего ряда стандартных электродных потенциалов выделить только те электродные процессы, которые отвечают общему уравнению:
Mt+n + n e- = Me0
то получим ряд напряжения металлов. В этот ряд всегда помещают водород, что позволяет видеть какие металлы способны вытеснять водород из водных растворов кислот. Положение того или иного металла в ряду напряжений характеризует его способность к окислительно–восстановительным взаимодействиям в водных растворах при стандартных условиях. Ионы металлов являются окислителями, а металлы в виде простых веществ – восстановителями. При этом, чем ближе металл к началу ряда, тем более сильные восстановительные свойства проявляет простое вещество – металл. Потенциал электродного процесса
2 H+ + 2 e- ↔ H20
В нейтральной среде (рН=7) равен Ц0 = -0,059•7=-0,41 В. Активные металлы в начале ряда, имеющие потенциал значительно больше, чем -0,41 В, вытесняют водород из воды. Металлы, расположенные между магнием и кадмием, обычно не вытесняют водород из воды. На поверхности этих металлов образуются оксидные пленки, обладающие замкнутым действием.
Металлы, расположенные между магнием и водородом, вытесняют водород из растворов кислот. При этом на поверхности некоторых металлов так же образуются защитные пленки, тормозящие реакцию. Так, оксидная пленка на алюминии делает этот металл делает этот метал стойким не только в воде, но и в растворах некоторых кислот. Свинец не растворяется в серной кислоте при ее концентрации ниже 80%, так как образующаяся при взаимодействии свинца с серной кислотой соль PbSO4 нерастворима и создает на поверхности металла защитную пленку. Явление глубокого торможения окисления металла, обусловлено наличием на его поверхности оксидных и солевых пленок, называется пассивностью, а состояние металла при этом – пассивным состоянием.
Металлы способны вытеснять друг друга из растворов солей. Направление реакции определяется при этом их взаимным положением в ряду напряжений. Рассматривая конкретные случаи таких реакций, следует помнить, что активные металлы вытесняют водород не только из воды, но и из любого водного раствора. Поэтому взаимное вытеснение металлов из растворов их солей практически происходит лишь в случаях металлов, расположенных в ряду после магния.
Вытеснение металлов из их соединения с другими металлами впервые подробно изучил Бекетов. В результате своих работ он расположил металлы по их химической активности в «вытеснительный ряд», являющийся прототипом ряда напряжений металлов.
Взаимное положение некоторых металлов в ряду напряжений и в периодической системе на первый взгляд не соответствует друг другу. Например, согласно положению в периодической системе химическая активность калия должна быть больше, чем натрия, а натрия — больше, чем лития.
В ряду же напряжений наиболее активным оказывается литий, а калий занимает среднее положение между литием и натрием. Цинк и медь по их положению в периодической системе должны иметь приблизительно равную химическую активность, но в ряду напряжений цинк расположен значительно раньше меди. Причина такого рода несоответствий состоит в следующем.
При сравнении металлов, занимающих то или иное положение в периодической системе, за меру их химической активности — восстановительной способности — принимается величина энергии ионизации свободных атомов.
Действительно, при переходе, например, сверху вниз по главной подгруппе I группы периодической системы энергия ионизации атомов уменьшается, что связано с увеличением их радиусов (т. е. с большим удалением внешних электронов от ядра) и с возрастающим экранированием положительного заряда ядра промежуточными электронными слоями. Поэтому атомы калия проявляют большую химическую активность—обладают более сильными восстановительными свойствами,—чем атомы натрия, а атомы натрия — большую активность, чем атомы лития.
При сравнении же металлов в ряду напряжений за меру химической активности принимается работа превращения металла, находящегося в твердом состоянии, в гидратированные ионы в водном растворе. Эту работу можно представить как сумму трех слагаемых: энергии атомизации — превращения кристалла металла в изолированные атомы, энергии ионизации свободных атомов металла и энергии гидратации образующихся ионов. Энергия атомизации характеризует прочность кристаллической решетки данного металла. Энергия ионизации атомов — отрыва от них валентных электронов — непосредственно определяется положением металла в периодической системе.
Энергия, выделяющаяся при гидратации, зависит от электронной структуры иона, его заряда и радиуса.
Ионы лития и калия, имеющие одинаковый заряд, но различные радиусы, будут создавать около себя неодинаковые электрические поля. Поле, возникающее вблизи маленьких ионоз лития, будет более сильным, чем поле около больших ионов калия. Отсюда ясно, что ионы лития будут гидратироваться с выделением большей энергии, чем ноны калия.
Таким образом, в ходе рассматриваемого превращения затрачивается энергия на атомизацию и ионизацию и выделяется энергия при гидратации. Чем меньше будет суммарная затрата энергии, тем легче будет осуществляться весь процесс и тем ближе к началу ряда напряжений будет располагаться данный металл. Но из трех слагаемых общего баланса энергии только одно — энергия ионизации—непосредственно определяется положением металла в периодической системе. Следовательно, нет оснований ожидать, что взаимное положение тех или иных металлов в ряду напряжений всегда будет соответствовать их положению в периодической системе. Так, для лития суммарная затрата энергии оказывается меньшей, чем для калия, в соответствии с чем литий стоит в ряду напряжений раньше калия.
Положение того или иного металла в ряду напряжений характерихует его способность к оксилительно – восстановительным взаимодействиям в водных растворах при стандартных условиях. Чем дальше расположен металл в ряду напряжений, тем более сильным окислителем в водном растворе являются его ионы, чем ближе металл к началу ряда, тем более сильные восстановительные свойства проявляет металл.
При сравнении металлов в ряду напряжений химической активности принимается работа превращений металла, находящегося в твердом состоянии, в гидратированные ионы в водном растворе.
Эту работу можно представить как сумму трех слогаемых:
- энергия атомизации – превращение кристалла металла в изолированные атомы;
- энергия ионизации свободных атомов металла;
- энергия гидротации образующихся ионов.
Ряд напряжений характеризует лишь окислительно-восстановительную способность Электрохимической системы «металл — ион металла» в строго определенных условиях; водный раствор, температура 25°С,единичная концентрация ионов металла.
Ряд напряжений характеризует химические свойства металлов:
1) Металлы, обладающие более отрицательным электродным потенциалом, способны вытеснять менее активные металлы, с более положительным потенциалом, из водных растворов и их солей.
Чем левее находится металл в ряду напряжений, тем легче окисляется и тем труднее восстанавливаются его ионы. Чем более отрицательный электродный потенциал металла, тем больше его восстановительная способность.
Zn0 + CuCl2 → Cu0 + ZnCl2
2) Каждый металл этого рода, не размягчающий воду, восстанавливает все последующие (вытесняет из растворов солей).
3) Металлы, стоящие в ряду напряжений до водорода, вытесняют водород из разбавленных растворов кислот (кроме HNO3).
То есть все металлы левее водорода в электрохимическом ряду напряжения металлов действуют на катионы водорода как восстановители.
Fe + H2SO4 (разб) = FeSO4 + H2 ↑
4) Чем дальше расположены друг от друга в ряду напряжения металлов, тем большую ЭДС будет иметь построенный на них элемент.
Электрохимический ряд напряженности
| Уравнение электродного процесса | Стандартный потенциал (Ц0) В при t=250C |
| Li+ + e- = Li0 | -3.045 |
| Rb+ + e- = Rb0 | -2.925 |
| K+ + e- = K0 | -0.925 |
| Li+ + e- = Li0 | |
| Li+ + e- = Li0 | |
| Li+ + e- = Li0 | |
| Li+ + e- = Li0 | |
| K+ + e- = K0 | |
| Li+ + e- = Li0 | |
| Li+ + e- = Li0 | |
| Li+ + e- = Li0 | |
| Li+ + e- = Li0 | |
 2018-01-21
2018-01-21 5077
5077