ЭДС (Е) гальванического элемента равна разности потенциалов двух его электродов.
Е=К-А; Е = больший потенциал – меньший потенциал электрода.
Такую величину она будет иметь при условии что металлы погружены в растворы, которых концентрация их ионов =1моль/литр. При других, концентрациях растворов величины электродных потенциалов будут иными.
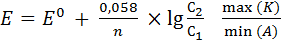
Пример1: Найти электродвижущую силу элемента, образованного цинковым электродом, опущенным в 0,1М раствор Zn(NO3)2 и единственным электродом, опущенным в 2М раствор Pb(NO3)2
Решение: вычислить потенциал каждого электрода.
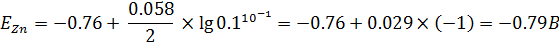
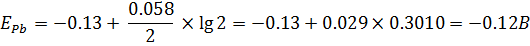
Находим ЭДС: E= -0.12-(-0.79)=0.67 B
Zn + Pb(NO3)2 = Pb + Zn (NO3)2
Пример 2: Никелевые пластинки опущены в растворы MgSO4, NaCl, CuSO4, AuCl3, ZnCl2, Pb(NO3)2. С какими солями никель будет реагировать? Напишите уравнения реакций в молекулярной и ионной форме.
Ni + CuSO4→ Cu+ Ni SO4
Ni + Pb(NO3)2→ Ni(NO3)2 + Pb
Ni + AuCl3→ NiCl3 +Au
Пример3: В шесть пробирок налиты растворы MgSO4, HgCl2, CuSO4, Al2(SO4)2, AgNO3, SnCl2. В каждую пробирку брошено по кусочку цинка. В каких пробирках произошла реакция? Выразите молекулярными и ионными парами.
Zn + HgCl2
Zn + CuSO4
Zn + AgNO3
Zn + SnCl2
Пример 4: Составьте два элемента, в одном из которых медь(Cu) являлась бы катодом, а в другом- анодом. Напишите уравнения реакций, происходящих при работе этих элементов, укажите приблизительные величины их электродвижущих сил.
Fe / FeSO4 // CuSO4 / Cu
A K
Ox Loe
Cu / CuSO4 // AgSO4 / Ag
A K
Ox Loe
ЭДС = K – A
Пример 5: Какие процессы будут происходить у электродов при работе гальванического элемента, состоящего из пластинок Al и Ag, погруженных: первая в 0,01 М раствор алюминиевой соли, а вторая в 2 М раствор AgNO3. Какова будет ЭДС этого элемента, если считать, что диссоциировали полностью (нацело). (2,52В)
Пример 6: Составьте уравнения электродных процессов и токообразующей реакции, протекающей при работе гальванического элемента:
А(окисление) К(восстановление)
а) Fe / Fe2+ (1М) // Sn 2+ (0,1М) / Sn
б) Zn / Zn2+ (0,01М) // Bi 3+ (0,2М) / Bi
Вычислите ЭДС гальванического элемента при указанных концентрациях. Укажите окислитель и восстановитель. Е=К-A
Пример 7: Из четырех металлов выберите те пары, которые дают наибольшую и наименьшую ЭДС составленного из них гальванического элемента.
а) Ag, Cu, Al, Sn
б)Co, Ti, Pt, Mg
 2018-01-21
2018-01-21 3514
3514








