Металлы — группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Большая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Металлы в природе находятся в самородках(золото, платина) и рудах (оксиды металлов или соли).Из руды металлы извлекаются с помощью химического или электролитического восстановления. В пирометаллургии для преобразования руды в металлическое сырьё используются высокие температуры, в гидрометаллургии применяют для тех же целей водную химию. Используемые методы зависят от вида металла и типа загрязнения. Некоторые металлы, такие как алюминий и натрий, не имеют ни одного экономически оправданного восстановителя и извлекаются с применением электролиза.
Способы получения металлов:
1) одним из главных способов получения металлов из руд основан на восстановлении их оксидов углем: Cu2O + C = 2Cu + CO;
2) производят выплавку чугуна из железных руд, получение олова из оловянного камня SnO2 и восстановление других металлов из оксидов;
3) для получения металлов из сернистых руд, последние вначале переводят в сернистые соединения с помощью обжигания в специальных печах

4) Металл можно получить путем электролиза. С его помощью получают одни из наиболее активных металлов.
5) Промышленные способы получения металлов: пирометаллургический, электрохимический, гидрометаллургический.
Металлический сплав — макроскопический однородный металлический материал, состоящий из смеси двух или большего числа химических элементов с преобладанием металлических компонентов.
Методы получения сплавов: 1)Охлаждением расплавов смесей. 2)Совместным осаждением из газовой фазы. 3)Эдектроосаждением из растворов. 4) Эдектроосаждением из расплавов.
Металлы и сплавы делятся на: 1)Чёрные-это сплавы железа с углеродом, содержащие в малых количествах кремний, марганец, фосфор, серу и другие химические вещества. Они делятсячугун и сталь. 2) Цветные металлы делятся на: а) тяжёлые, б)легкие
В твердом агрегатном состоянии сплав может быть гомогенным (однородным, однофазным — состоит из кристаллитов одного типа) и гетерогенным (неоднородным, многофазным).
Интерметалли́д (интерметаллическое соединение) — химическое соединение двух или более металлов, которые образуют хим. соединение.
Эвтектика - сплав, состав которого даёт самую минимальную температуру плавления.
Сплавы проявляют металлические свойства, например: электропроводность и теплопроводность, отражательную способность (металлический блеск) и пластичность.
39Вода, физические и химические свойства.
Вода́ (оксид водорода) — химическая формула Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеет цвета (в малом объёме), запаха и вкуса. В твёрдом состоянии называется льдом, снегом или инеем, а в газообразном — водяным паром. Молекула воды является диполем.
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Вода на Земле может существовать в трёх основных состояниях — жидком, газообразном и твёрдом и приобретать различные формы, которые могут одновременно соседствовать друг с другом: водяной пар и облака в небе, морская вода и айсберги, ледникии реки на поверхности земли, водоносные слои в земле.
Вода в нормальных атмосферных условиях сохраняет жидкое агрегатное состояние, тогда как аналогичные водородные соединения являются газами. Это объясняется особыми характеристиками слагающих молекулы атомов и присутствием связей между ними. Атомы водорода присоединены к атому кислорода, образуя угол 104,45°, и эта конфигурация строго сохраняется. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды является активным диполем, где кислородная сторона отрицательна, а водородная положительна. В результате молекулы воды притягиваются своими противоположными полюсами и образуют полярные связи, на разрыв которых требуется много энергии.
Вода обладает отрицательным электрическим потенциалом поверхности.
Чистая вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония H3O+) и гидроксильных ионов HO− составляет 0,1 мкмоль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть в воде присутствуют положительные и отрицательные ионы. Благодаря этому вода проводит электричество
Воду можно получить в ходе реакций:
В ходе реакций нейтрализации: 
Восстановлением оксида меди водородом: 
Вода реагирует при комнатной температуре: 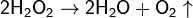
с активными металлами (натрий, калий, кальций) 
со фтором и межгалоидными соединениями 
с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз: 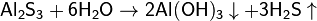
Вода реагирует при нагревании:
с железом, магнием: 
 2018-01-21
2018-01-21 2475
2475
