1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. 
2. Взаимодействие с кислородом. 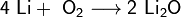
3. Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов 
Общая формула оксидов щелочных металлов – M2O.
-Хорошо растворяются в воде, реагируя с ней: M2O + H2O = 2MOH.
- Реагируют с кислородом, водородом, серой и хлором: 2Na2O + O2 = 2Na2O2;
-Проявляют свойства основных оксидов, реагируют с кислотными оксидами и кислотами: Li2O + 2HCl = 2LiCl + H2.
Общая формула гидроксидов щелочных металлов – MOН.
Все гидроксиды проявляют свойства сильных оснований. В воде практически нацело диссоциируют: NaOH = Na+ + OH-.
Реагируют с оксидами неметаллов: KOH + CO2 = KHCO3;
Взаимодействуют с кислотами, вступают в реакцию нейтрализации:
NaOH + HCl = NaCl + H2O;
Вступают в обменные реакции с солями:
2NaOH + CuCl2 = Cu(OH)2 + 2NaCl.
Реагируют с галогенами: 2KOH + Cl2 = KClO + KCl + H2O (на холоде);
В расплавленном состоянии взаимодействуют с амфотерными металлами и их оксидами:
2KOH + Zn = K2ZnO2 + H2;
2KOH + ZnO = K2ZnO2 + H2O.
Водные растворы гидроксидов при взаимодействии с амфотерными металлами, их оксидами и гидроксидами образуют гидроксокомплексы:
2NaOH + Be + 2H2O = Na2[Be(OH)4] + H2;
34_) р-элементы IVA группы. Их химические свойства и соединения на примере углерода.
p-Элементы имеют общую электронную конфигурацию ns2np1–6 и образуют подгруппы IIIА,IVА, VА, VIА, VIIА и VIIIА периодической системы.
В подгруппе IIIА рассматривают отдельно B, Al и подгруппу галлия (Ga, In, Tl), в IVА – C, Si и подгруппу германия (Ge, Sn, Pb), в VА – N, P и подгруппу мышьяка (As, Sb, Bi), в VIА – O и подгруппу халькогенов (S, Se, Te, Po), в VIIА – галогены (F, Cl, Br, I, At), в VIIIА – Ne, Ar и подгруппу криптона (Kr, Xe, Rn).
В отличие от s-элементов, p-элементы поливалентны. Высшие положительные степени окисления равны номеру группы, отрицательные – числу неспаренных электронов для элементов IVА–VIIА подгрупп. Для элементов подгруппы Kr возможны только формально положительные четные степени окисления.
При переходе сверху вниз в подгруппах возрастает разница энергий s- и p-подуровней, поэтому легким элементам свойственны высшие степени окисления, тяжелым – низшие. Так, в подгруппе IVА стабильность соединений Э2+ возрастает в ряду Ge2+< Sn2+< Pb2+. В той же последовательности уменьшается устойчивость соединений Э4+. Подтверждением этому служит изменение термической устойчивости водородных соединений ЭH4.
Восстановительные свойства p -элементов в группе сверху вниз усиливаются, а окислительные ослабевают.
IIIA: B, Al, In, Tl, Ga(степень окисления +3, кроме Tl- +1);
Реагируют с:галогенами,серой, азотом, кроме Тl, с углеродом Al: Al4C3-карбид алюминия.
Al, Ga, In образуют оксиды при нагревании, а на воздухе покрываются оксидной пленкой.
Самый распространенный металл на Земле – Al. Высокопрочный, легкий, не коррозийный.
Сплавы Al:
Дюралюминий(Al – 94%, Cu – 4%, Mg, Fe, Si, Mn по 0,5%)
Силумин(Al – 85-90%, Si – 10-14%, Na – 0.1%)
Применяются как конструкционные изделия в авиа-, авто-, судо-, космостроении. Используется как легирование для повышения жаростойкости.
Al2O3 – хороший абсорбент, входит в состав драгоценных камней таких как рубин, сапфир.
IVA: C, Si, Ge, Sn, Pb, Fl
Валентность 2 либо 4
Sn встречается в виде оловянного камня – SnО2
Pb в виде галенита PbS
Si в виде песка, кварца – SiО2
Легко переходіт в состояніе кварцевого стекла. Монокристаллический кремний – материал для лазерных зеркал(газовые лазеры).
Силикаты:
75% земной коры – сілікаты. Стекло получают при сплавлении силикатов и других соединений:
Na2CO3+CaCO3+SiO2=Na2O*CaO*6SiO2+CO2
 2018-01-21
2018-01-21 878
878








