Изменить величину энергии активации можно с помощью специальных веществ, вещества принимающие участие, но не расходующие во время реакции называются катализаторами.
В зависимости от того находится ли катализатор в той же фазе что и реагирующие вещества или образует самостоятельную фазу, говорят о гомогенном или гетерогенном катализе.
Механизм каталитического действия, для них не одинаков, однако и в том и в другом случае происходит ускорение реакции за счёт движения энергии реакции.
А+В ->A..B ->AB Ea-энергия активации
Придобавление катализа реакции происходит в 2 стадиях с образованием промежуточных активированных комплексов.
1) A+K ->A..K -> AK E|a
2) AK+B -> AK..B -> AB+K E||a
Реакция в присутствии катализатора проходит с большей скоростью и с меньшей энергии активации.
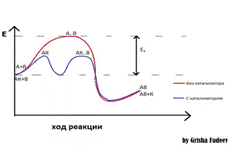
Придобавление катализатора энергия активации значительно снижается, что ускоряет химический процесс.
Каталитический путь оказывает кинетически более выгодный, чем прямое взаимодействие исходных веществ.
|
|
|
Увеличение скорости реакции в присутствии катализатора определяется формулой:
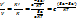 ;
; 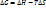 ;
; 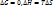
27) Растворы. Классификация растворов. Движущие силы образования растворов (Δ S и Δ G).
Растворы- гомогенные системы переменного состава, состоящие из двух или более веществ.
По характеру агрегатного состояния растворы могут быть:-газообразные–жидкие-твердые
Обычно компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор считают растворителем, остальные составляющие раствора – растворенные вещества.
Компонент раствора, который взят в избытке – растворитель, в зависимости от размера частиц растворенного вещества растворы делятся на истинные и коллоидные. В истинных растворах растворенное вещество находится на атомном или молекулярном уровне. Эти частицы невидимы ни визуально, ни под микроскопом. Такие растворы считаются термодинамически устойчивыми и стабильными во времени. В коллоидных растворах размер частиц составляет от 1 до 100млмикрон.
ДВИЖУЩИМИ СИЛАМИ ОБРАЗОВАНИЯ РАСТВОРОВ ЯВЛЯЮТСЯ ЭНТРОПИЙНЫЙ И ЭНТАЛЬПИЙНЫЙ ФАКТОР. При растворении газов в жидкости энтропия всегда уменьшается, при растворении кристаллов энтропия возрастает.
Энтальпия играет важную роль в том случае, если в данном растворе присутствует сильное взаимодействие растворенного вещества и растворителя. Чаще всего это сказывается, когда растворяем кристаллическое вещество в жидкости.
Знак изменения энтальпии растворения определяется знаком суммы всех тепловых эффектов, процессов, сопровождающих растворение. Этотпроцесссостоитиздвухстадий:
|
|
|
1) разрушение кристаллической решетки на свободные ионы и процесс этот эндотермический (∆Н>0)
2) взаимодействие образовавшихся ионов с молекулами растворителя – процесс экзотермический (∆Н<0)
H +OH -NaCl+ H 2O↔ NaCl
∆G=∆H-T∆S
Переход вещества в раствор сопровождается значительным возрастанием энтропии вследствии стремления системы к разупорядоченности и всегда соблюдается, что ∆G<0
Для жидких растворов (расплавы) процесс растворения идет самопроизвольно до установления равновесия между раствором и твердой фазой.
Концентрация раствора определяется растворимостью вещества при данной температуре. Растворимость для различных веществ колеблется в различных пределах и зависит от природы самих веществ, взаимодействия частиц растворенного вещества между собой и молекулами растворителя. Такжерастворимостьзависитотвнешнихусловий.
 2018-01-21
2018-01-21 753
753








