Химическое равновесие:Термодинамическим условием химического равновесия является значение:∆G=0
При химическом равновесии скорость реакции в прямом направлении равна скорости реакции в обратном направлении. В условиях химического равновесия концентрация исходных веществ и продуктов реакции не изменяется во времени и называются равновесными концентрациями. Для характеристики состава химического равновесия было введено понятие константа химического равновесия. Эта величина определяется из закона действующих масс и представляет собой отношение концентраций продуктов реакций и исходных веществ.
аА+вВ‹―›сС+dD
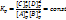
Это уравнение является вариантом математического уравнения закона действующих масс и формулирует: отношение произведений равновесных концентраций продуктов реакций в степенях их стехиометрических коэффициентах к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов при постоянной температуре является величина постоянная (Const.)
|
|
|
Влияние различных факторов на сдвиг химического равновесия:
С повышением температуры равновесие смещается в сторону эндотермических реакций, т.е. реакций протекание которых обеспечивает поглощение теплоты. Повышение температуры вызывает увеличение константы равновесия, соответственно возрастают отношения концентраций продуктов реакции к концентрации исходных веществ, т.е. равновесие смещается в сторону эндотермической реакции.
2)Влияние общего давления в системе
Если в результате реакции изменяется число молей газообразного вещества, то изменение общего давления в системе вызывает смещение равновесия в соответствии с принципом Ле-Шателье, увеличение общего давления в системе вызывает смещение равновесия в сторону уменьшения числа молей газообразного вещества, т.е. в сторону уменьшения давления.
3)Влияние концентрации компонентов системы.
Если в систему добавить Метан, т.е. увеличить концентрацию, то равновесие системы нарушится. При этом ускоряется прямая реакция, что приводит к увеличению концентрации продуктов реакции. В результате происходит уменьшение концентрации газообразной воды и равновесие смещается вправо. Процесс будет протекать до тех пор, пока не установится новое равновесие. Новое равновесие концентрации всех компонентов будет таким, чтобы константа равновесия оставалась постоянной.
Принцип Ле-Шателье
При внешнем воздействии на систему происходит смещение химического равновесия, т.е. изменение равновесной концентрации исходных веществ и продуктов реакции. Если в результате внешнего воздействия увеличится равновесие концентрации исходных продуктов реакции, то говорят о смещении равновесия вправо, если вследствие внешнего воздействия увеличится равновесие концентрации исходных веществ, то говорят о смещении влево. Характер вмещения под влиянием внешних воздействий можно прогнозировать, применяя принцип Ле-Шателье.
|
|
|
Принцип: Если на систему находящуюся в равновесном состоянии оказывается внешнее воздействие, то равновесие смещается в таком направлении которое ослабляет внешнее воздействие.
Принцип следует из закона действующих масс, если система находится при постоянной температуре, то константа равновесия при внешних воздействиях остается постоянной, поэтому любое изменение равновесных концентраций одного или нескольких веществ должно приводить к такому изменению равновесных концентраций других веществ, чтобы соблюдалась константа равновесия.
 2018-01-21
2018-01-21 2618
2618
