В условиях постоянных температуры и давления самопроизвольно
могут протекать только такие процессы, для которых G<0. В
положении равновесия G=0.Если G>0, то реакция в прямом направлении
Самопроизвольно не идет, но идет самопроизвольно в обратном
Направлении.
3. Особенности термодинамических систем организма:
Термодинамические системы организма являются:
1. Открытыми, непрерывно обменивающимися с внешней средой
веществом и энергией.
2. Гетерогенными.
3. Процессы в живых системах необратимы.
4. Живые системы не находятся в равновесном состоянии.
1. Если в ходе реакции энергия Гиббса понижается (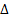 G<0), то такая реакция
G<0), то такая реакция
протекает самопроизвольно и называется экзэргонической.
Например, окисление глюкозы кислородом:
С6Н12О6+ 6О2+6СО2+ 6Н2О сопровождается уменьшением энергии Гиббса, 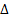 G0Р-ЦИи=2880кДж/моль, т.е. этот процесс экзэргонический.
G0Р-ЦИи=2880кДж/моль, т.е. этот процесс экзэргонический.
2. Если в ходе реакции энергия Гиббса повышается (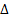 G>0), то такая реакция
G>0), то такая реакция
невозможная без внешнего подвода энергии и называется эндэргонической.
Например, процесс фотосинтеза в растениях: 6СО2+ 6Н2О=С6Н12О6+6О2 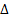 G0Р-ЦИИ= +2880кДж/моль идет только под воздействием солнечной энергии (hv).
G0Р-ЦИИ= +2880кДж/моль идет только под воздействием солнечной энергии (hv).
В организм человека поступают большие молекулы белков, жиров,
углеводов, имеющие высокую упорядоченность, которые гидролизуютсядо
небольших молекул. Энтропия резко возрастает, но этому препятствует
выделение мочевины, углекислого газа, воды и т.п. из организма. Так
поддерживается стационарное состояние, но для этого необходимы
постоянные затраты энергии Гиббса. Убыль энергии Гиббса восполняется за
счет окисления пищевых продуктов.
 2018-01-21
2018-01-21 237
237







