1. Влияние температуры. Скорость ферментативных реакций
подчиняется правилу Вант–Гоффа, но имеются некоторые ограничения
(см. ранее).
2. Влияние рН. Для каждого фермента (а значит и для скорости)
существует свой оптимум рН. Если построить графически зависимость
активности фермента от рН, то оказывается, что максимальная
активность достигается в узком интервале рН. Кривая имеет
колоколообразный характер
Для каждого фермента существует определенное значение рН, при котором
его действие оптимально. Для большинства ферментов оптимальные значения
рН совпадают с физиологическими значениями (7,3–7,4). Однако, существуют
ферменты, для нормального функционирования которых нужна сильнокислая
(пепсин – фермент желудочного сока – 1,0–2,0) или достаточно щелочная
(аргиназа – фермент, участвующий в удалении из организма NH3в виде
мочевины – 9,5–9,9) среда. Фермент слюны – амилаза, под действием которого
крахмал и гликоген распадаются до мальтозы, активен при рН, равном 6,8, что
соответствует рН слюны.
3. Влияние концентрации субстрата.
Объясняется теорией Михаэлиса–Ментен. Субстрат S (в-во) образует
с молекулой фермента Е (русское название фермента – энзим) соединение ES:
S+E=ES (1)
ES – фермент–субстратный комплекс, он может либо распадаться обратно до S
и E, либо образовывать продукт реакции Р и регенерированную молекулу
фермента Е:
E+S=E+P (2)
Скорость ферментативной реакции описывается уравнением Михаэлиса–
Ментен:
V=  (3)
(3)
где k2– константа реакции распада фермент–субстратного комплекса, [Е0] – концентрация фермента (и связанного в комплекс, и свободного), [S] – концентрация субстрата, Km– константа Михаэлиса.
Зависимость скорости реакции от концентрации субстрата имеет следующий вид:
Максимальная скорость достигается, когда все наличное количество фермента [Е0] окажется связанным в виде фермент–субстратного комплекса:
Vmax=k2*(E0) (4)
Поэтому величина максимальной скорости ферментативной реакции зависит от концентрации фермента в системе.
Исходя из уравнений (3) и (4) уравнение Михаэлиса–Ментен можно записать так:
V= 
Биохимические реакции, как правило, протекают не с максимальной скоростью, это энергетически не выгодно, а со скоростью  Эта скорость достигается при концентрации субстрата, равной Km. В этом – физический смысл константы Михаэлиса. То есть для обеспечения скорости, равной половине максимальной, требуется концентрация субстрата, равная константе МихаэлисаKm
Эта скорость достигается при концентрации субстрата, равной Km. В этом – физический смысл константы Михаэлиса. То есть для обеспечения скорости, равной половине максимальной, требуется концентрация субстрата, равная константе МихаэлисаKm
4. Влияние активаторов и ингибиторов. В организме для регуляции ферментативных процессов используются активаторыи ингибиторы. Активаторами ферментов часто бывают катионы металлов: Mg2+, Mn2+, Zn2+, Co2+, K+, иногда – анион Cl–, которые, реагируя с ионизированными группами фермента, облегчают образование фермент–субстратного комплекса.
5. На активность ферментов влияют такжеокислительно–восстановительный потенциал среды,ионная сила раствора,различные виды облучения (рентгеновское, УФО, γ–лучи). Действие всех этих факторов обеспечивается через влияние на активные центры или на строение ферментов (изменяют нативную структуру белка).
Химическое равновесие Понятие термодинамического равновесия нами уже рассматривалось (ΔG=0). Рассмотрим химическое равновесие с позиций химической кинетики. Пусть обратимая реакция описывается уравнением: aA+ bB= dD+fF. Во всех обратимых реакциях скорость прямой реакции уменьшается, а скорость обратной реакции возрастает до тех пор, пока скорости станут равными, и установится состояние равновесия. Это равновесие – динамическое
aA+ bB= dD+fF (1)
Запишем выражения для скорости прямой и обратной реакции:
V1=k1  *
* 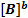 (2)
(2)
В состоянии равновесия V1=V2, т.е.
k1  *
* 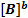 =k2
=k2  *
*  (3)
(3)
Поделим обе части уравнения на величину k2  *
*  :
:
 =
=  (4)
(4)
 =kр-константа хим.равновесия (5)
=kр-константа хим.равновесия (5)
 =kр=
=kр= 
Константа химического равновесия КРравна отношению произведений концентраций продуктов к произведению концентраций реагентов с учетом стехиометрических коэффициентов. Это постоянная величина при постоянных внешних условиях. Чем выше константа равновесия, тем больше в равновесной реакционной смеси продуктов реакции. Чем ниже константа, тем больше исходных веществ. Например, для обратимой реакции связывания кислорода гемоглобином (HНв) с образованием оксигемоглобина (HНвО2) величина КР=1300 при 37оС. Это значит, что при давлении кислорода, равном 1атм., равновесная концентрация оксигемоглобина в 1300 раз превышает концентрациюгемоглобина. Другими словами, равновесие реакции сильно смещено вправо:
На химическое равновесие влияют следующие факторы: температура, концентрация, давление (газы), объем (газы), катализатор не влияет.
6.Химическое равновесие Понятие термодинамического равновесия нами уже рассматривалось (ΔG=0). Рассмотрим химическое равновесие с позиций химической кинетики. Пусть обратимая реакция описывается уравнением: aA+ bB= dD+fF. Во всех обратимых реакциях скорость прямой реакции уменьшается, а скорость обратной реакции возрастает до тех пор, пока скорости станут равными, и установится состояние равновесия. Это равновесие – динамическое
aA+ bB= dD+fF (1)
Запишем выражения для скорости прямой и обратной реакции:
V1=k1  *
* 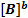 (2)
(2)
В состоянии равновесия V1=V2, т.е.
k1  *
* 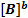 =k2
=k2  *
*  (3)
(3)
Поделим обе части уравнения на величину k2  *
*  :
:
 =
=  (4)
(4)
 =kр-константа хим.равновесия (5)
=kр-константа хим.равновесия (5)
 =kр=
=kр= 
Константа химического равновесия КРравна отношению произведений концентраций продуктов к произведению концентраций реагентов с учетом стехиометрических коэффициентов. Это постоянная величина при постоянных внешних условиях. Чем выше константа равновесия, тем больше в равновесной реакционной смеси продуктов реакции. Чем ниже константа, тем больше исходных веществ. Например, для обратимой реакции связывания кислорода гемоглобином (HНв) с образованием оксигемоглобина (HНвО2) величина КР=1300 при 37оС. Это значит, что при давлении кислорода, равном 1атм., равновесная концентрация оксигемоглобина в 1300 раз превышает концентрациюгемоглобина. Другими словами, равновесие реакции сильно смещено вправо:
На химическое равновесие влияют следующие факторы: температура, концентрация, давление (газы), объем (газы), катализатор не влияет.
Принцип ЛеШателье: Если на систему, находящуюся в равновесии, воздействовать каким–либо фактором (Т, C, P, V), то равновесие сместится в направлении той реакции, протекание которой ослабляет этой воздействие.
1.Повышение температуры приводит к смещению химического равновесия в том направлении, при котором происходит поглощение теплоты (эндотермическая реакция), а понижение, наоборот, в сторону экзотермической реакции.
2. Повышение концентрации вещества смещает равновесие в сторону реакции, в результате которой его концентрация уменьшается.
3. Повышение давления (для газов) приводит к сдвигу химического равновесия в сторону образования веществ, занимающих меньший объем.
4. Катализатор не влияет на смещение химического равновесия, но может увеличить скорость достижения равновесия. Катализатор позволяет превратить самопроизвольную, но медленную реакцию в быстропротекающую; но никакой катализатор сам по себе не заставит осуществляться несамопроизвольную реакцию
 2018-01-21
2018-01-21 1269
1269
